Bilan électronique
Savoir écrire des structures de Lewis obéissant strictement à la règle de l’octet est une règle d’hygiène indispensable si l’on désire comprendre la chimie. Pour ceux qui ont des difficultés en ce domaine, voici une méthode simple d’emploi et rigoureuse. On ne considère ici que le cas de molécules formées d’atomes n’ayant pas d’orbitales de valence de type “d” (métaux de transition) ou “f” (lanthanides et actinides) de valence.
En premier lieu, il convient de faire la partition entre le nombre d’atomes d’hydrogène h et les autres q. On arrive ainsi à une formule du type AqHhz, où z représente la charge électrique globale. Cette dernière vaut zéro pour une molécule. Elle est positive ou négative pour une espèce ionique. Puis, il faut calculer le nombre total d’électrons de l’espèce considérée. On l’obtient en sommant le nombre d’électrons de valence des q atomes lourds, ni, le nombre d’atomes d’hydrogène, h, et en retranchant la charge algébrique z. En divisant ce nombre par 2, on obtient le nombre total de paires électroniques V :
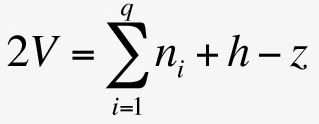
Règle stricte de l’octet
La règle stricte de l’octet permet de trouver comment doivent se répartir ces paires électroniques entre liaisons simples (σ), doubles ou triples (π) et doublets non partagés (λ). Soit, V = σ + π + λ. Cette règle d’origine quantique stipule que chaque atome lourd cherche à s’entourer de quatre paires électroniques. Ceci correspond au remplissage de l’orbitale ns et des 3 orbitales np disponibles. On suppose, en outre, que chaque atome d’hydrogène possède en partage une seule paire d’électrons. Cette contrainte résulte du remplissage de l’orbitale 1s de cet atome.
Avec q atomes lourds et h atomes d’hydrogène, le nombre maximum de paires admissibles vaut donc Nmax = 4q + h. Or, chaque liaison simple ou multiple aboutit au partage d’un doublet. S l’on dispose d’un total de V paires, on peut écrire : V = Nmax – σ – π. Maintenant, si l’on admet au minimum une liaison simple par paire d’atomes, il vient :
σ = h + q + (c – 1)
Ici, c est le nombre de cycles formés. Ce paramètre vaut zéro (c = 0) pour un ion ou une molécule branchée, c’est-à-dire un objet non cyclique. Avec cette contrainte, il existe une relation entre le nombre de paires d’électrons V, le nombre de cycles indépendants c, le nombre d’atomes lourds q et le nombre total de liaisons multiples π : V = 4q + h – h – q + (1 – c) – π. D’où la relation :
V + c = 3q – π + 1
Une fois que l”on a pu déterminer le nombre de liaisons multiples π, il est possible d”en déduire le nombre de paires non partagées λ = V – σ – π, soit :
λ = 2V – 4q – h
Cas limites
Il est important de noter que la première condition portant sur les liaisons simples σ peut toujours être, a priori, satisfaite. Toutefois, les deux autres peuvent poser problème. En effet, il est d’une part impossible d’avoir plus de 2 liaisons multiples par atome lourd. D’autre part, les valeurs de π et de λ ne peuvent pas être négatives… Si les trois relations peuvent être mutuellement satisfaites, on est sûr d’avoir affaire à une molécule stable. Celle-ci pourra donc être synthétisée et isolée à l’état gazeux.
Dans le cas contraire, il faudra être beaucoup plus prudent. Le composé ne peut alors exister qu’à l’état solide comme dans le cas du chlorure de sodium NaCl. Une autre possibilité est l’existence de formes hybrides de résonance, comme dans le cas des molécules BH3 ou SF6.
Charges formelles
Une fois connue les valeurs (σ, π, λ) il reste à écrire une structure raisonnable. Les atomes d”hydrogène doivent être systématiquement placés en position terminale sauf si le système est déficitaire en électrons. Pour les atomes lourds, la notion d’électronégativité est d’une grande utilité. Car, les formes les plus stables sont celles où l’on trouve le maximum d’atomes électronégatifs en position terminale.
A ce stade, on peut chercher les possibilités de résonances en déplaçant les liaisons sans modifier la position des noyaux. 5. Ayant un schéma de Lewis, il reste à placer les charges formelles φ sur les atomes. Pour cela, on retranche du nombre d’électrons de valence, ni, le nombre d’électrons formellement présents autour de l’atome considéré. Ici, un doublet non-liant λ compte pour 2 électrons et un doublet partagé (σ ou π) pour un seul électron :
φ(X) = nX – 2×λX – σX – πX
On notera que l’oubli des charges formelles sur une structure de Lewis est inadmissible. Car, l’on se prive ainsi d’une information précieuse pour la réactivité chimique de la molécule concernée.
Formes hypervalentes
Supposons que soit déterminée la structure de Lewis avec sa distribution de charges formelles associée. Il sera généralement possible d’annuler ces charges en rajoutant des liaisons multiples. On obtiendra en procédant de la sorte des formes dites “hypervalentes”. Bien que cela soit fait dans de nos nombreux ouvrages, nous ne recommandons pas cette attitude. Car, ce faisant on viole la règle de l’octet. Cette situation n’est pas défendable sur le plan théorique.
En effet, écrire des formes hypervalentes nécessite de faire intervenir des orbitales d généralement hautes en énergie. Les résultats des calculs quantiques montrent de fait que la contribution de ces orbitales d à la liaison chimique est toujours négligeable devant la contribution des orbitales s ou p (règle de l’octet). Le seul cas où il est légitime de faire intervenir des niveaux d concerne les métaux de transition qui obéissent donc à la règle des 18 électrons = 2x(1 + 3 + 5), plutôt qu’à la règle de l’octet. Cette règle s’applique aussi aux lanthanides ou aux actinides.
HOMO et LUMO
Sur un plan quantique, on peut également établir, à l’aide de diagrammes de Lewis, la nature de la HOMO d’une molécule. Cet acronyme anglais signifie Highest Occupied Molecular Orbital. De même, il est aussi possible d’obtenir la nature de la LUMO. Ce nouvel acronyme signifiant, Lowest Unoccupied Molecular Orbital. Pour ce qui concerne la HOMO on enlève une paire électronique, et on tente de réécrire une formule de Lewis obéissant à la règle de l’octet. Si la structure à laquelle on arrive obéit à la règle de l’octet, on regarde quel type de liaison (σ ou π) est apparu. La HOMO est alors une orbiatle σ* ou π* anti-liante). En cas de disparition, la HOMO est alors une orbitale σ ou uπ-liante).
Pour discuter de nature de la LUMO on rajoute une paire électronique. On cherche de nouveau à écrire une structure de Lewis obéissant à la règle. Cela permet alors de déduire la nature de la LUMO : orbitale σ* ou π* anti-liante si une liaison σ ou π a disparue. On aura, au contraire, une orbitale σ ou π-liante si une liaison σ ou π est apparue. Dans l’un (HOMO) ou l’autre cas (LUMO), l’orbitale frontière sera généralement non liante s’il n’est pas possible de proposer une structure de Lewis obéissant à la règle de l’octet.
Exemple
Proposez une structure de Lewis obéissant strictement à la règle de l’octet pour la taurine molécule non cyclique de formule brute C2H7NO3S. Si vous ne trouvez pas, cliquez ici pour la solution.
Références
K.F. Purcell and J.C. Kotz, Inorganic Chemistry, pp. 65-74, W.B. Saunders Company, Philadelphie (1977).
J.L. Reed, “The Lewis Structure: An Expanded Perspective”, J. Chem. Educ., 71 (1994) 98-100.
D.G. DeWit, “Using Formal Charges in Teaching Desciptive Inorganic Chemistry”, J. Chem. Educ., 71 (1994) 750-755.
D.K. Straub, “Lewis Structures of Boron Compounds Involving Multiple Bonding”, J. Chem. Educ., 72 (1995) 494-497 (1995).
L. Suidan, J.K. Badenhoop, E.D. Glendening et F. Weinhold, “Common Textbook and Teaching Misrepresentations of Lewis Structures”, J. Chem. Educ., 72 (1995) 583-586.



Leave a Reply