Épisode 11, Covid-19, mai 2020
Cellules
Dans cette chronique, je vais passer en revue les mécanismes de défense de notre corps contre les infections virales ou bactériennes. Si l’on souhaite développer des traitements préventifs (vaccins) ou curatifs (médicaments), il est impératif de comprendre l’aspect répressif de ce type de réponse. Pour se mettre dans l’ambiance, il faut savoir que le mot cellule dérive du latin cellula (petite chambre). Ce mot latin dérive lui-même de cella (local fermé), terme lui-même issu du verbe celare (cacher, dissimuler). D’où le dogme de la biologie moléculaire : « Omnis cellula e cellula ». Il s’agit ici d’un hommage vibrant rendu aux vertus de l’incarcération. On peut aussi considérer un tel dogme comme une évocation des vertus d’une vie monacale.
Le terme choisi pour parler de l’unité de base du vivant n’est évidemment pas très heureux. Cela évoque un monde carcéral où la contrainte physique règne en maître. La cellule évoque aussi un monde où une contrainte morale s’applique de manière volontaire à soi-même. Il existe un terme moins oppressant basé, lui, sur le mot grec kytos signifiant « cavité ». Ce terme a donné naissance au préfixe cyto– ou au suffixe -cyte accolés généralement à un autre mot grec pour spécifier la fonction de ladite cavité.
Leucocytes
Les leucocytes, du grec leukos signifiant « blanc », assurent la force policière d’une cellule. On appelle cela le système immunitaire. Ces troupes de leucocytes patrouillent en permanence dans les systèmes sanguins et lymphatiques. Ils font la police et nettoient les scènes où se déroulent les odieux crimes viraux ou bactériens. Les leucocytes écoutent en permanence des sonnettes d’alarme appelées cytokines. On retrouve ci, la racine grecque cyto- couplée avec le mot grec kinêsê qui signifie « mouvement ». Les cytokines sont généralement émises en grande quantité sur toute scène criminelle. À l’instar du miel pour les fourmis, les cytokines attirent irrésistiblement les leucocytes vers le lieu du crime.
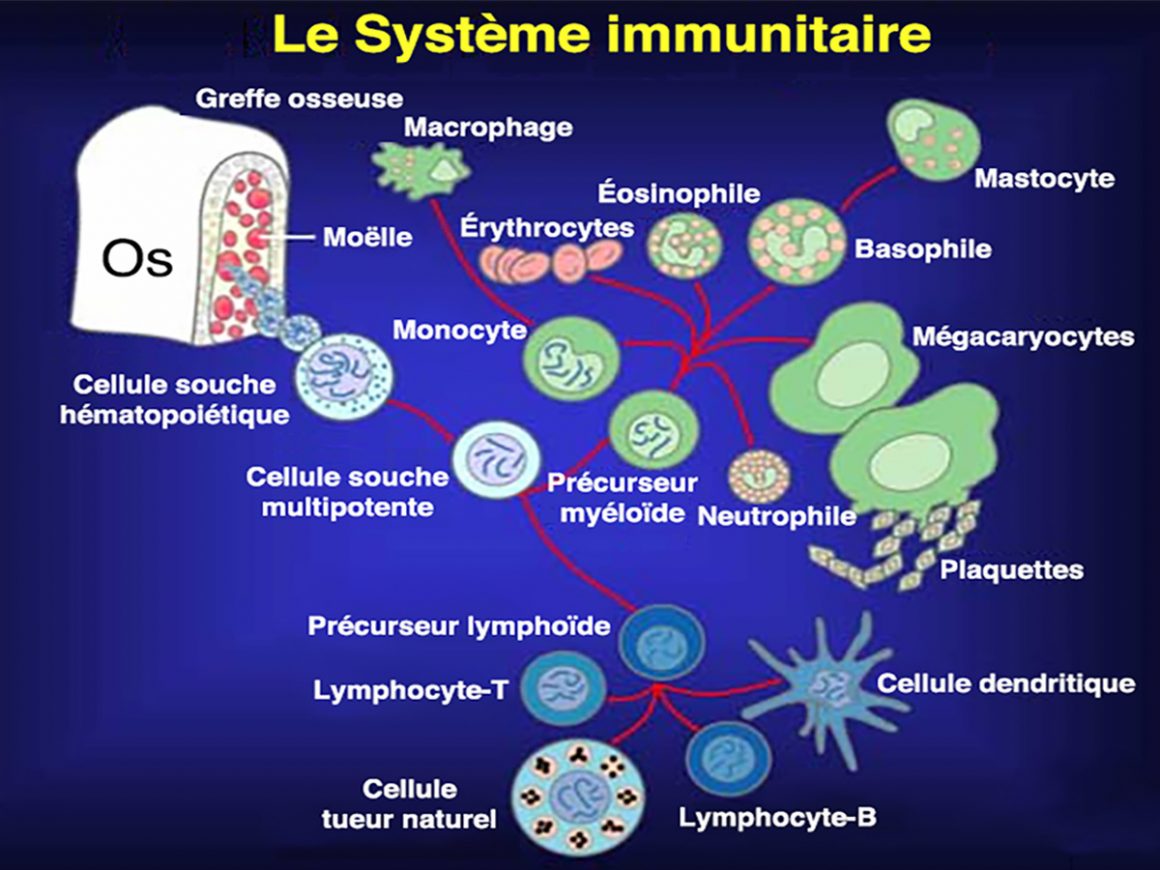
Tous les leucocytes sont des émetteurs de cytokines. Ces petites molécules forment un large spectre de molécules d’alarme sur lesquelles je reviendrais une autre fois. Sept grands types cellulaires constituent la force d’intervention rapide dite innée :
Basophiles
– Les basophiles (0,5-1 % des leucocytes sanguins) sont des leucocytes qui ont une forte affinité pour les colorants basiques. Ces cellules spécialisées ont la capacité de relâcher des molécules d’histamine afin de dilater les vaisseaux sanguins. En même temps, il y a relargage de molécules d’héparine qui empêchent le sang de coaguler. Grâce aux basophiles, les autres leucocytes peuvent aisément se déplacer vers le lieu de l’infection.
Neutrophiles
– Les neutrophiles (60-70 % des leucocytes sanguins) se développent, comme leur nom l’indique, en milieu neutre (6.5 ≤ pH ≤ 7.5). Ce sont des cellules très mobiles aptes à se faufiler très rapidement dans ce que l’on appelle l’interstitium. Il s’agit du réseau hydrique qui percole tous les tissus de notre corps. Lorsqu’ils se trouvent en surabondance sur le lieu du crime, ils forment ce l’on appelle communément le « pus ». Les neutrophiles ont trois moyens d’action.
Dans un processus appelé phagocytose, les neutrophiles peuvent digérer toute cellule. Ce mot dérive du grec phagos signifiant « mangeur ». À l’instar des basophiles, les neutrophiles sont capables d’entrer en dégranulation. Ceci afin d’émettre des molécules solubles toxiques pour les microbes. Leur dernier rôle connu est de lancer en milieu extra-cellulaire de véritables filets de capture. Des filaments d’ADN et d’histones, petites protéines fortement associées à l’ADN, forment ces filets.
Monocytes
– Les monocytes, ont un nom qui dérive du mot grec, monos, qui signifie « seul, unique ». Ce sont de véritables aspirateurs cellulaires capables d’avaler à peu près n’importe quoi comme nos aspirateurs ménagers. Ces cellules ont une durée de vie nettement plus longue que celle des neutrophiles. Tout ce qu’un neutrophile est incapable de traiter, se retrouve pris en charge par un monocyte. Lorsqu’ils quittent le milieu sanguin pour aller dans les tissus on obtient des macrophages (du grec macro signifiant « très grand »).
Les cellules dendritiques sont des monocytes qui colonisent certains tissus. Les tissus colonisés sont ceux qui sont en contact avec le milieu extérieur : peau, nez, poumons, estomac ou intestins. On retrouve ici le mot grec, dendron, signifiant « arbre ». Une fois chargées en débris microbiens, les monocytes migrent vers les vaisseaux lymphatiques. Ceci afin d’aller présenter lesdits débris aux cellules du système immunitaire adaptatif. Ceci permet qu’ils soient fichés et mémorisés pour une reconnaissance future.
Éosinophiles
– Les éosinophiles (2-4 % des leucocytes) présentent une très grande affinité pour le colorant acide de couleur rose-orangé appelé éosine. Ce nom dérive du grec héôs qui signifie « aurore ». Les éosinophiles sont des leucocytes qui se développent en cas d’allergies ou d’infections par des parasites. Les maladies du collagène, de la rate ou du système nerveux central ont besoin des éosinophiles. On en trouve très peu dans le sang. Ils sont en revanche présents en très grand nombre dans les muqueuses respiratoires, digestives et le canal urinaire inférieur. Leur rôle est de secréter des molécules chimiques aptes à tuer de très grands parasites. Des vers, trop gros pour être digérés par les monocytes, font le régal de ces cellules très spécialisées.
Mastocytes
– Les mastocytes sont des cellules immunitaires dont la maturation, au sein d’un tissu hôte, est dictée par le micro-environnement tissulaire. Lors de leur découverte en 1878, on pensait qu’ils permettaient via leurs granules de nourrir le tissu conjonctif environnant. Le nom de ces cellules dérive du grec mastos, qui signifie « mamelle ». Les mastocytes sont présents dans les tissus richement vascularisés. Ils y assurent une interface avec l’environnement comme dans les poumons, la peau et le tube digestif. Ce sont, comme les basophiles, des cellules sécrétrices, capables de stocker et de libérer par dégranulation, de multiples médiateurs de l’inflammation. De nombreuses situations pathologiques font appel aux mastocytes.
Tueurs naturels
– Les cellules natural killer (NK) sont des lymphocytes de type T (voir plus bas) du système lymphatique. Ils sont capables de tuer des cellules tumorales et des cellules infectées tout en épargnant les cellules saines du soi. C’est pour cela qu’elles sont qualifiées de « naturelles ». Ce faisant, elles fournissent des débris cellulaires qui peuvent être présentés aux cellules du système immunitaire adaptatif. Elles secrètent en même temps leurs propres cytokines, de manière à façonner la réponse adaptative exercée par les autres lymphocytes.
– Un dernier groupe de cellules sont les lymphocytes de type T à récepteurs gamma-delta. Ils peuvent réaliser, sous certaines conditions, la phagocytose de manière innée. Ce type très particulier de cellule se localise principalement dans les tissus. Comme le révèle ce nom assez énigmatique, la manière de fonctionner de ces cellules reste encore très mal connue.
Lymphocytes
Comme expliqué dans la chronique précédente les lymphocytes sont des leucocytes du système immunitaire inné. C’est une ligne de défense aveugle aux identités exactes des agresseurs. Pour les lymphocytes, le fait qu’il y a eu émissions de cytokines signifie que des individus indésirables circulent. Les lymphocytes peuvent détecter toute effraction. Ce sont les gardiens des cellules du corps. Grâce aux cytokines émises par les cellules en détresse, ils reniflent la piste. Ceci leur permet de converger très rapidement vers le lieu de l’effraction. Arrivés sur place, ils évaluent les dégâts et procèdent au nettoyage de tout ce qui a été endommagé.
En particulier, les lymphocytes réduisent en bouillie tout agresseur qui se retrouve dans une cellule. Leur passage génère un grand nombre de débris, appelés antigènes. Ceci nécessite l’intervention des macrophages, des cellules dendritiques ou des mastocytes. Ces dernières cellules récupèrent soigneusement ces antigènes, dont la nature chimique est très variable. L’idée est ici de faire un inventaire précis de ces fragments initialement portés par des agents pathogènes.
Certaines substances naturelles (protéine, polysaccharide, lipide) sont potentiellement productrices d’antigènes. Un antigène peut aussi provenir d’une substance toxique pour le corps. Le destin de tout antigène est d’être transporté, via le système lymphatique, vers des ganglions. Là, ils rencontrent des lymphocytes T et B qui dérivent de cellules souches hématopoïétiques multipotentes présentes dans la moelle épinière.
Lymphocytes-B
Une fois devenus matures, les lymphocytes de type B natifs passent directement dans le système lymphatique à la recherche d’antigènes. Chaque lymphocyte-B dispose de millions de globulines appelées anticorps que l’on retrouve enchâssés dans la membrane. Les globulines ont la capacité de se lier de manière hautement spécifique à un antigène donné. Après capture d’un antigène, le lymphocyte-B peut se diviser pour devenir un lymphocyte-B à mémoire. Ce type de cellule reproduit alors sur sa membrane exactement le même anticorps. Après migration dans les tissus le lymphocyte-B peut devenir un plasmocyte apte à rendre ces mêmes anticorps libres de circuler. Les lymphocytes-B possèdent aussi un récepteur spécialisé pouvant avaler l’antigène. Ceci, afin de relâcher des cytokines et communiquer ainsi avec les autres leucocytes.
Lymphocytes-T
Après leur maturation dans la moelle épinière, les lymphocytes de type T sont, eux, envoyés vers le thymus. D’où la lettre ’T’, qui les accompagne. Arrivés dans le thymus, ils y développent des glycoprotéines. On parle alors de clusters de différentiation (sigle CD). Chaque cluster porte un numéro de série et se trouve inapte à se lier directement aux antigènes en circulation. Pour que la reconnaissance moléculaire puisse avoir lieu, les antigènes doivent d’abord être liés à des protéines réceptrices membranaires. De telles protéines s’appellent complexes majeurs d’histocompatibilité (MHC) de classe 1 ou 2. Ces protéines se trouvent à la surface des cellules présentatrices d’antigènes.
Avant de quitter le thymus, les lymphocytes-T subissent des tests. Ceci permet de s’assurer qu’ils ne peuvent se lier qu’aux MHC du soi (sélection positive). Ils ne doivent, en aucun cas, se lier aux MHC du soi non porteurs d’antigènes (sélection négative). Tout lymphocyte-T qui échoue à ces deux tests est éliminé par apoptose. Trois types de lymphocyte-T sont ainsi produits. Il y a tout d’abord les lymphocytes auxiliaires Th qui possèdent le récepteur dit “CD4”. Ces lymphocytes auxiliaires participent à l’activation des autres leucocytes. On trouve ensuite les lymphocytes cytotoxiques TC qui possèdent le récepteur dit “CD8”. Ils ont la responsabilité d’éliminer sans pitié les pathogènes et les cellules hôtes infectées. Il y a enfin les lymphocytes régulateurs Treg qui possèdent le récepteur CD4 et un autre dit “CD25”. Ils aident à distinguer entre molécules du soi et du non-soi.
Échelles de temps
Voilà, très résumé, l’arsenal répressif mortifère dont dispose notre corps pour se défendre en cas d’infection bactérienne ou virale. On notera que la réponse innée se mesure en minutes ou en heures. La réponse adaptative nécessite, pour sa part, des jours pour se mettre en branle. L’intérêt de la réponse lente est qu’elle protège un individu de manière permanente sur plusieurs années. Cette durée peut même s’étendre à la vie toute entière. Toutefois, il arrive que la sélection des lymphocytes à la sortie du thymus soit compromise. Si tel est le cas, cette force policière protectrice peut aussi devenir menaçante. Elle provoque alors ce que l’on appelle une maladie auto-immune.
Par Marc HENRY


Leave a Reply