L’eau sous forme de glace
La glace est la forme solide qu’adopte l’eau lorsque la température descend en dessous de 0°C. On peut déterminer la structure cristalline de la glace via la diffraction des rayons X sur monocristal. Ces mesures ont montré qu’il n’existait pas une seule forme de glace. Mais, de nombreuses autres présentant des topologies différentes [1]. Le point commun entre toutes ces formes de glaces est la présence du pentamère à structure tétraédrique (H2O){H2O}4. On trouve dans un tel assemblage une molécule d’eau engagée dans des liaisons hydrogène avec quatre autres molécules d’eau.
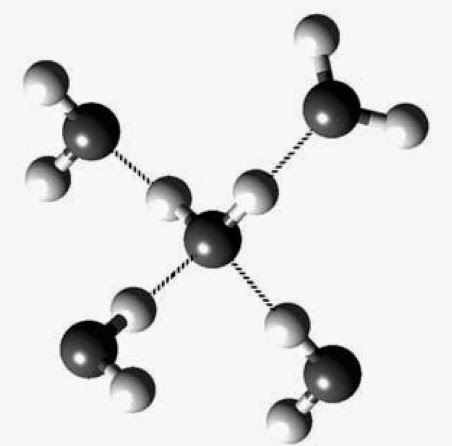
Polymorphes cristallins
Cette unité structurale de base (H2O){H2O}4 est de fait extrêmement flexible. Elle donne naissance à pas de moins de 15 polymorphes cristallins notés Ic, Ih et de II à XIV. On a aussi recensé pas moins de 3 phases amorphes différentes. Voici le diagramme de phase extrêmement complexe de la glace :
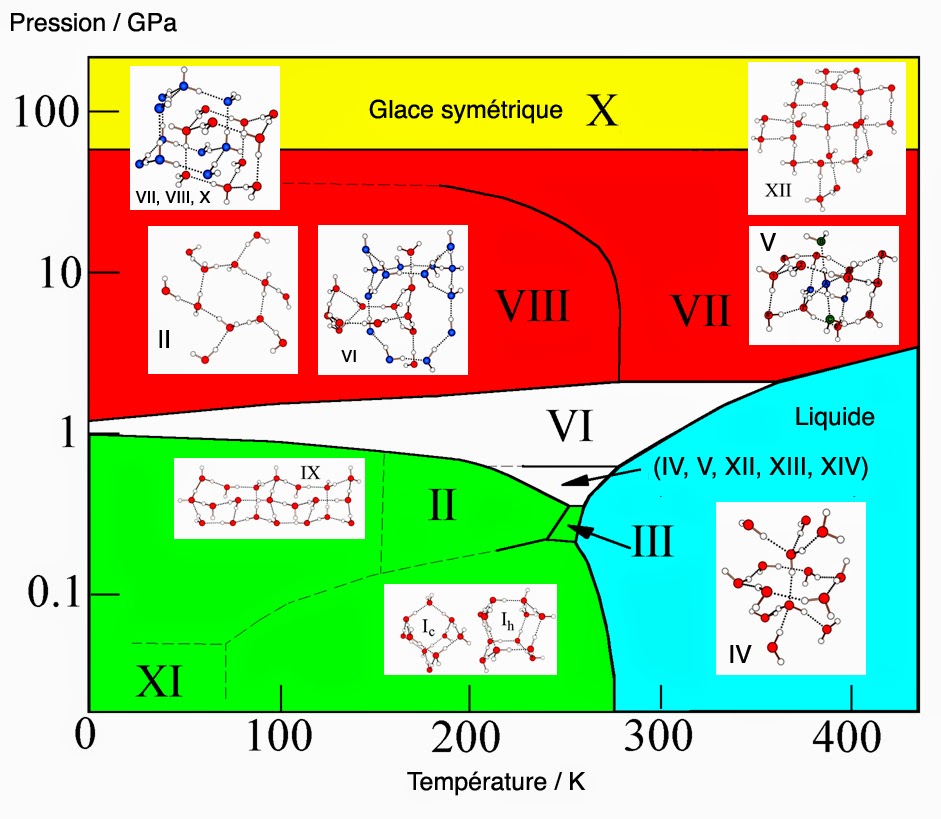
Parmi les 15 polymorphes cristallins, 3 paires peuvent être identifiées (Ih, XI), (III, IX) et (VII, VIII). Elles correspondant à la même structure dans deux versions différentes. Premièrement, une forme complètement désordonnée. Ici, il n’est pas possible de différencier entre atomes d’oxygène donneur et accepteur (polymorphes Ih, III et VII). Deuxièmement, une version complètement ordonnée où cette différentiation est possible (polymorphes XI, IX et VIII).
On notera que les polymorphes V et XII, également désordonnés, n’avaient pas d’équivalent ordonné jusqu’en 2006. Depuis, deux nouveaux types de glace notée XIII et XIV ont pu être préparées. Premièrement, la glace V par dopage à l’acide chlorhydrique et refroidissement (T = 80K) sous une pression de 0,5 GPa. Deuxièmement, la glace XII qui se forme sous une pression de 1,2 GPa. Voici maintenant une animation pour les glaces dites à structure « ouvertes » (Ih, Ic, II, III, IX, XI, XII, et XIV) :
Ici, une autre animation pour les glaces à double réseau de liaison hydrogène interpénétré (IV, V, VI, VII, VIII, X et XIII) :
Propriétés
La table suivante compare ces 15 polymorphes du point de vue de leur densité et de la stabilité de la liaison hydrogène :
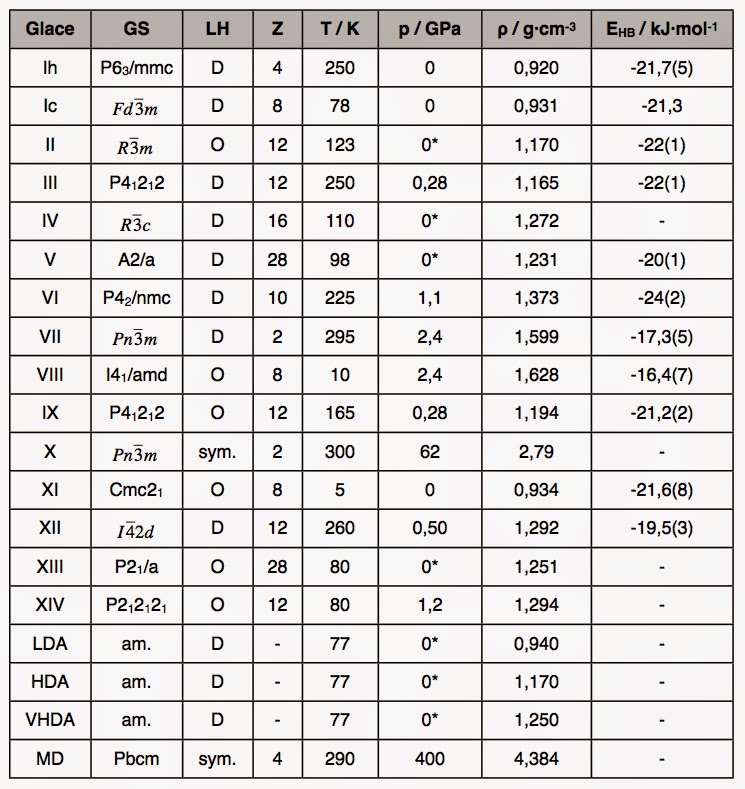
Pour ce qui concerne la stabilité de la liaison hydrogène, ce tableau montre qu’en dessous de p = 1 GPa, on trouve une valeur, EHB= -21(2) kJ·mol-1très voisine de celle trouvée dans les clusters d’eau isolés. Au dessus de 1 GPa, la liaison tend à être affaiblie et se symétrise vers p = 100 GPa pour donner une glace symétrique (notée X) où il n’y a plus de distinction entre atomes d’oxygène de type donneur ou accepteur puisque l’hydrogène se place juste au milieu des deux atomes d’oxygène.
Référence
[1] V. F. Petrenko & R.W. Withworth, « Physics of ice », Oxford University Press, Oxford (1999).



Leave a Reply