Modèle de Sommerfeld
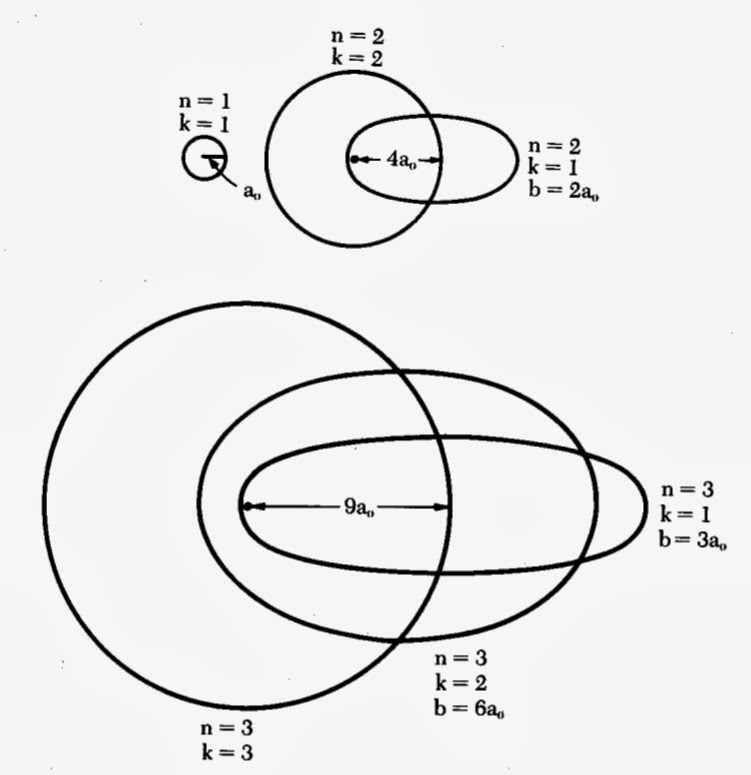
Le physicien danois Niels Bohr (1885-1962) supposait que le mouvement des électrons autour du noyau correspondait à des « orbites » circulaires. Ces cercles pouvaient s’indexer au moyen d’un nombre quantique principal n. Le physicien allemand Arnold Sommerfeld (1868-1951), lui réalisa qu’il s’agissait plutôt d’ellipses. Ceci impliquait deux nombres quantiques et non plus un seul. Le premier entier principal avait pour symbole n’. Il s’agissait d’un nombre entier positif ou nul quantifiant le mouvement radial de l’électron. L’autre entier avait pour symbole la lettre k. Ce nombre, dit azimutal, était strictement positif. Il quantifiait le mouvement orbital de l’électron dans le plan de l’ellipse définie par le nombre n’.
Grâce à un traitement relativiste, Sommerfeld démontra la quantification de l’énergie de l’atome à l’aide d’une paire de nombres (n = n’+k, k), selon l’expression :
E(n,k) = -Z^{2}\cdot R\cdot h\cdot c\left\lbrack\frac{1}{n^{2}} + \frac{\alpha ^{2}\cdot Z^{2}}{n^{4}}\left (\frac{n}{k} - \frac{3}{4}\right )\right \rbrackIci, h·c = 198 644,57 nm·zJ et R = 10 973 731.6 m-1 désigne la constante de Rydberg. On pouvait ainsi classer toute orbite stationnaire au moyen de deux nombres quantiques. On avait d’une part, le nombre quantique principal n strictement positif. Il y avait d’autre part, le nombre quantique azimutal k qui était soumis à la contrainte 0 < k ≤ n. Le rapport k/n mesurait le rapport qui existait entre le demi-axe mineur et le demi-axe majeur de l’ellipse orbitale. Les orbites circulaires de Bohr correspondaient au cas où k = n, soit n’ = 0. Les termes pour lesquels k = 1, 2, 3, 4… eurent comme symboles les lettres ‘s’, ‘p’, ‘d’, ‘f’… Ceci était en relation avec la première lettre du nom de la série de raies correspondantes dans spectre de l’atome d’hydrogène : sharp, principal, diffuse, fundamental.
Constante de structure fine α
Pour prendre en compte l’existence de l’effet Zeeman, Sommerfeld introduisit aussi un troisième nombre quantique m. Ceci lui permettait de décrire les états atomiques en présence d’un champ magnétique. Le premier terme de la formule E(n, k) redonnait donc le résultat de Bohr (et donc la formule de Rydberg). Le second était quant à lui une petite correction. Dans son calcul, Sommerfeld avait introduit une notation α = 2πe2/hc. Rappelons que Sommerfeld travaillait dans le système cgs avec e en statcoulomb, h la constante de Planck et c la vitesse de la lumière dans le vide. Cette constante resta ensuite sous le nom de « constante de structure fine ». Il s’agit d’un nombre sans dimension proche du rapport 1/137, qui est petit devant 1. En système SI, e s’exprime en coulomb. Il faut dans ce cas introduire la permittivité du vide ε0 ce qui conduit à l’expression suivante :
\alpha =\frac{e^{2}}{2\epsilon _{0}hc}=\frac{1}{137,035999074(44)}Les termes en α2 dans E(n,k) sont donc négligeables en première approximation. Cette relation généralisée pour l’énergie permettait d’expliquer la structure fine du spectre d’émission de l’atome d’hydrogène. Autrement dit, le dédoublement de la raie d’émission Hα:
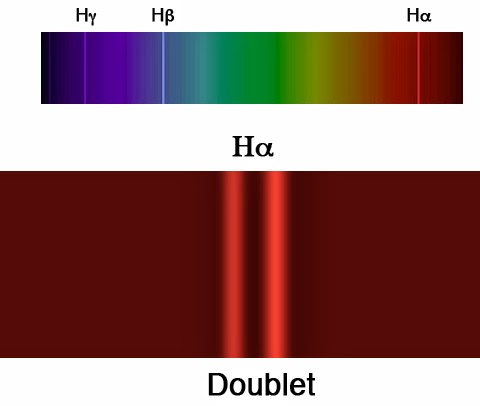
Multiplets atomiques
La question se posa alors de savoir si les deux nombres quantiques n et k suffisaient pour classifier toutes les structures en multiplets observées par spectroscopie d’émission en l’absence de champ magnétique. Jusqu’en 1922, on ne connaissait que des singulets, des doublets ou des triplets pour les termes spectraux atomiques. Toutefois, à partir de 1923, on savait que les multiplicités pouvaient aller jusqu’à des octuplets. L’amélioration de la spectroscopie, par Friedrich Paschen en particulier, montra que l’on n’observait pas toutes les transitions a priori possibles d’un niveau (n,k) vers un niveau (n’,k’). Il existait manifestement des règles de sélection.
Certaines transitions n’apparaissaient qu’en présence d’un champ magnétique ou électrique. D’autres n’apparaissaient pas du tout. Afin de trouver des règles de sélection Sommerfeld introduisit donc un troisième nombre quantique interne. Ce nombre se notait j selon une suggestion de Niels Bohr. Dans ce cadre, chaque terme spectroscopique possédait 3 nombres quantiques (n, k, j). Sommerfeld trouva ainsi que les doublets et les triplets des séries diffuses obéissaient à la règle de sélection ∆j = ±1 ou 0. Son collègue, Alfred Landé, montra qu’il fallait exclure toute transition allant d’un terme j = 0 vers un autre terme j = 0. Pour les multiplicités impaires, Sommerfeld associa aux termes ‘s’, les valeurs j = 0 pour les singulets. Cette valeur devenait j = 1 pour les triplets, j = 2 pour les quintuplets, etc.
Effet Zeeman anormal
Concernant les termes ‘p’, on avait j = 1 pour les singulets, j = 2,1,0 pour les triplets, j = 3,2,1 pour les quintuplets, etc. Pour les termes ‘d’, les singulets se caractérisaient par j = 2, les triplets par j = 3,2,1, les quintuplets par j = 4,3,2,1,0, et ainsi de suite. Cette manière de procéder purement empirique était évidemment loin d’être satisfaisante. Ce d’autant plus que pour rendre compte des multiplicités paires, il fallait avoir des valeurs de j demi-entières. Ceci ne faisait absolument aucun sens dans un cadre classique. On constata aussi que tous les états tels que j ≠ 0 présentaient un effet Zeeman anormal. On rechercha donc une explication satisfaisante pour la décomposition Zeeman des niveaux d’énergie par un champ magnétique.
Pour cela, Sommerfeld et Landé formulèrent l’hypothèse du cœur magnétique. Cette hypothèse autorisait les électrons non impliqués dans les transitions optiques. Autrement dit, ceux des couches internes. Ces couches internes avaient le droit d’avoir un moment angulaire, et donc un moment magnétique non nul. Toutefois, le physicien autrichien Wolfgang Pauli rejeta ce modèle empirique très complexe. Il le remplaça par un modèle basé sur 4 nombres quantiques (n, l, m, mj) au lieu des 3 (n, k, j) associé à un principe d’exclusion. Ceci allait permettre de résoudre le problème posé par l’effet Zeeman via l’introduction du spin. Grâce au spin, on pouvait aussi proposer un mode de construction du tableau périodique des éléments beaucoup plus satisfaisant.
Référence
Max Jammer, « The conceptual development of quantum mechanics », McGraw-Hill, New-York (1966)


Leave a Reply