Rapport isotopique
L’isotope 18O de l’oxygène joue un rôle primordial en climatologie. En effet, grâce à lui on peut définir ce que l’on appelle un « thermomètre isotopique ». Ce dernier permet de connaître la température moyenne de la planète terre au cours des siècles et des millénaires passés. De fait, le rapport entre les deux types d’oxygène (16O et 18O) dans l’eau change avec le climat. Il faut donc arriver à mesurer la variation du rapport 18O/16O dans les sédiments marins, les calottes glaciaires ou les fossiles. Rapporté à une référence standard universelle, on peut alors connaître le climat des époques passées.
La référence utilisée en climatologie se base sur le rapport isotopique 18O/16O de l’océan à une profondeur comprise entre 200 et 500 mètres. Dans la pratique, on soustrait du rapport isotopique mesuré, celui de l’eau de mer actuelle. Ce dernier est désigné par l’acronyme SMOW qui signifie « Standard Mean Ocean Water » ou « Eau Océanique Moyenne Standard ». Il se caractérise par un rapport (18O/16O)SMOW = 2 ‰.
Effet de la température
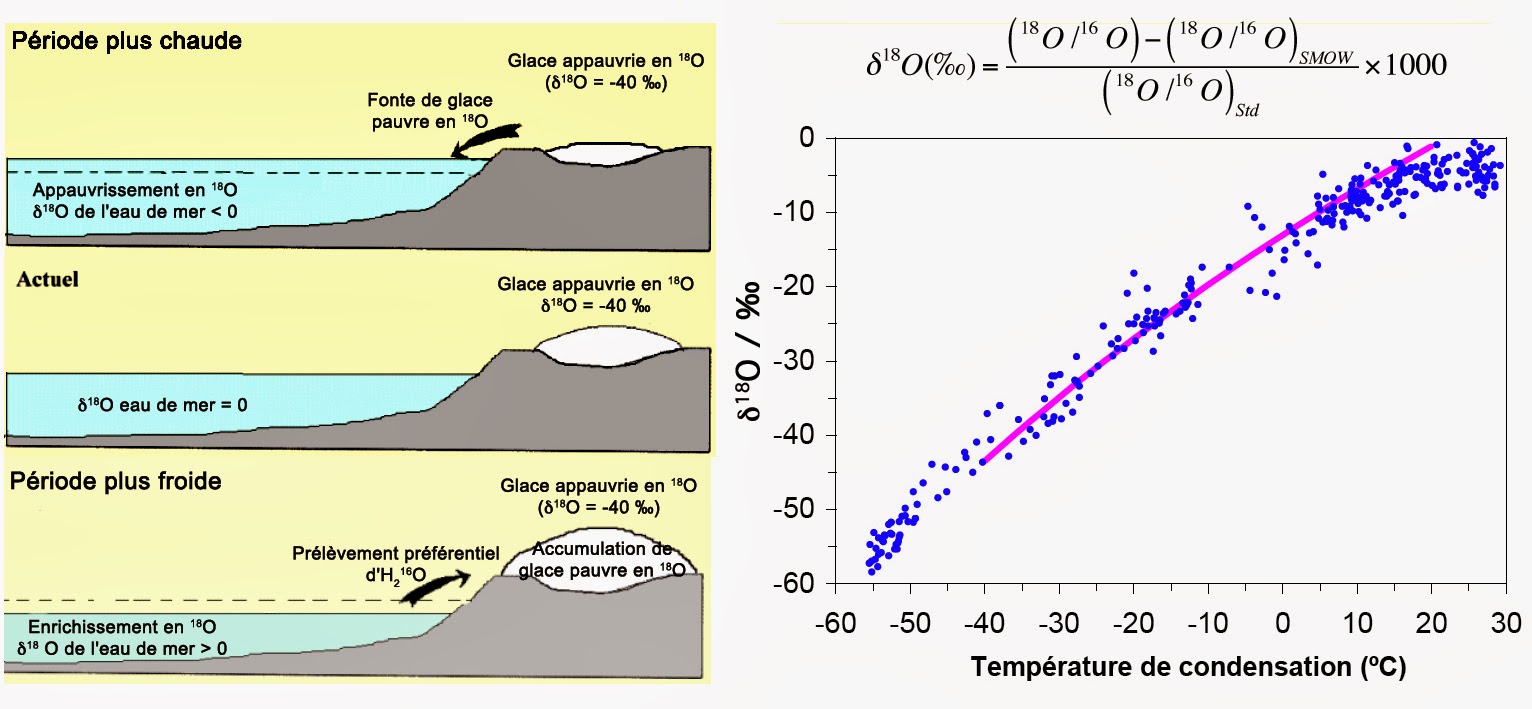
L’évaporation et la condensation sont les deux processus qui influencent le plus le rapport isotopique 18O/16O dans les océans. Les molécules 16OH2 étant plus massives que les molécules 18OH2, elles peuvent s’évaporer plus facilement. Pour la même raison, les molécules de l’isotopologue 18OH2 condensent plus facilement que celles de l’isotopologue 16OH2. Or, l’air se refroidit en s’élevant dans l’atmosphère, ou en se déplaçant vers les pôles. Ceci entrâine que l’humidité se condense et retombe sous forme de pluie enrichie en isotopologue 18OH2 plus facilement condensable.
La vapeur d’eau restante se trouve ainsi appauvrie en isotopologue 18OH2. Un tel appauvrissement se renforce au fur et à mesure que l’air se déplacer vers les régions polaires très froides. Plus on se rapproche des pôles, plus la pluie ou la neige se trouve donc enrichie en isotopologue 16OH2. Durant les périodes glaciaires, les températures froides se déplacent vers l’équateur. Ceci entraîne un enrichissement de la pluie en isotopologue 18OH2 aux plus basses latitudes en rapport avec des conditions plus douces. La vapeur d’eau ainsi enrichie en 16OH2, se déplace vers les pôles. elle termine son voyage en se condensant sur les calottes glaciaires où elle se trouve emprisonnée.
Paléoclimatologie
Suite à ces phénomènes, l’eau qui reste dans les océans s’enrichit donc en isotopologue 18OH2 par rapport au standard universel. De même, la glace aux pôles s’enrichit en isotopologue 16OH2. Une forte concentration en isotopologue 18OH2 dans les océans se trouve donc corrélée à une forte concentration en isotopologue 16OH2 dans les calottes polaires. Le rapport exact permet alors de connaître quelle quantité de glace recouvrait la Terre à une époque donnée.
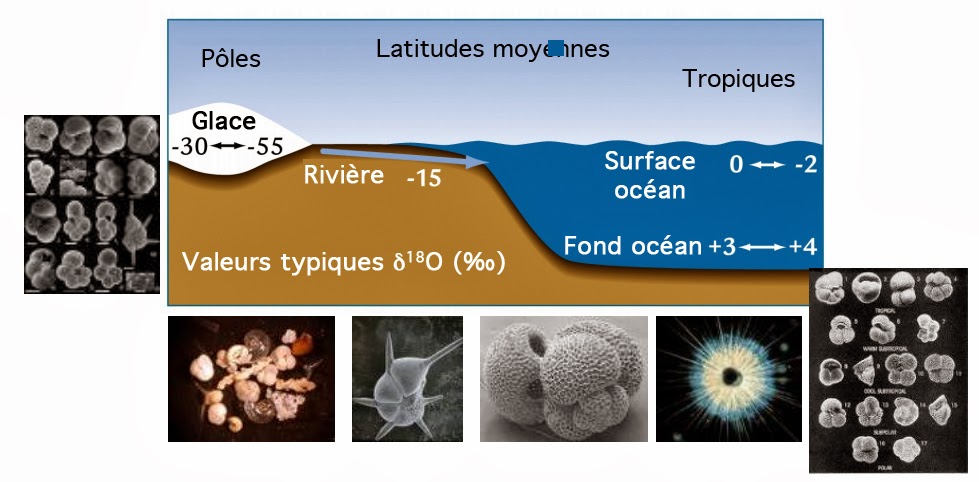
Si maintenant le climat se réchauffe, les calottes polaires fondent. L’eau de fonte se retrouve donc dans les océans. Ce qui réduit leur salinité et augmente leur teneur en isotopologue 16OH2. Les périodes chaudes sont donc celles où l’eau de mer présente un rapport isotopique 18O/16O supérieur à celui du standard universel. Car, il y a eu plus de précipitations. En paléoclimatologie, on utilise le rapport isotopique 18O/16O de l’eau des glaciers ainsi que celui des coquillages ou des plantes marines. Ceci permet d’avoir une idée des températures ainsi que du taux de précipitations du passé.
Coquillages et coraux
Pour les carottes glaciaires, la chose est simple. Puisque ici, un rapport faible indique des températures plus froides que le standard universel. Pour les coquillages, la mesure est beaucoup plus complexe. Car, les processus chimiques et biologiques à l’origine de la formation des coquilles biaisent le rapport isotopique de manière très variable en fonction de la température. Les coquilles du phytoplancton, du zoo-plancton ou des coraux sont constituées de calcaire CaCO3 ou de silice SiO2.
Lorsque ces solides se forment, ils tendent à s’enrichir en isotope 18O, quel que soit le rapport isotopique de l’eau. Plus la température de l’eau est basse, plus l’enrichissement est important. Il faut donc faire des corrections pour accéder au véritable rapport isotopique de l’océan. Cela se fait en regardant d’autres rapports isotopiques. Comme la balance entre le strontium (Sr) et le calcium (Ca) dans le cas des coraux. En effet, le rapport Sr/Ca dépend, lui aussi, fortement de la température. En mesurant ce rapport dans les coraux, on peut donc connaître la température de l’océan
Ceci permet alors d’estimer la quantité d’isotope 18O incorporée pour cette température. Des variations dans le rapport isotopique après cette correction de température, révèlent des changements locaux de la salinité de l’océan. Ceci est en relation avec les taux d’évaporation, de précipitation et d’écoulement des eaux, paramètres liés à la quantité totale de glace sur la Terre.


Leave a Reply