L’eau dans tous ses états
Toute substance chimique est susceptible d’exister selon la température ou la pression sous quatre états différents : solide, liquide, gaz et plasma. Un plasma est un milieu ayant la capacité de conduire les courants électriques et d’être donc sensible aux champs magnétiques. Les plasmas peuvent exister soit à l’état gazeux (étoiles, milieu interstellaire), soit à l’état solide (métaux qui sont en fait des plasmas “froids”). Vu la taille de l’univers (≈ 1026 m), c’est bien sous la forme de plasma que l’on a le plus de chances de rencontrer la matière dans l’univers. En raison de l’ionisation d’une partie ou de la totalité des atomes constituants, c’est en premier lieu le nombre d’électrons non associés aux noyaux que l’on trouve par unité de volume et la vitesse moyenne de ces électrons dits “libres” qui caractérise l’état plasma.
Il en découle que les propriétés des plasmas ne dépendent que très peu de la nature chimique des atomes ionisés. Il y aura donc peu de différence entre un plasma produit en ionisant de la vapeur d’eau et un autre plasma produit en ionisant de l’air par exemple. Oublions donc l’état plasma ultra-majoritaire dans l’univers (à plus de 99 %). Et, intéressons-nous plutôt aux 1 % de matière restante. On trouve alors deux états, les états solide et gazeux. Ceux-ci peuvent exister dans toute la gamme de pression P et de température T. Il y a aussi un autre état très particulier, l’état liquide. Ce dernier ne peut exister pour sa part que dans un domaine limité de pression et de température.
Point triple et point critique
En effet, pour toute substance pure, il existe un point unique (P, T) appelé “point triple”. En ce point, la substance existe en équilibre sous les trois états non ionisés : solide, liquide et gaz. Pour toute pression ou température inférieure aux valeurs du point triple, la substance ne peut exister qu’à l’état solide ou à l’état gazeux. Elle ne pourra donc jamais être observée sous forme liquide. De même, il existe un autre point (P, T) caractéristique, appelé “point critique”. Au-delà de ce nouveau point, il est également impossible d’observer l’état liquide. Ici aussi les seuls états observables sont le solide ou le gaz.
Pour quelle raison existe-t-il principalement 3 états pour la matière non ionisée et non 4 ou plus ? En fait, pour tout assemblage d’atomes, il se trouve que l’énergie cinétique de mouvement du centre de masse se répartit sur trois types de mouvement fondamentalement différents.
Trois types de mouvement
i) Le mouvement d’oscillation ou de vibration des atomes constituants au voisinage d’un centre de masse immobile. L’immobilité du centre de masse implique ici l’existence d’une énergie potentielle suffisamment forte pour que les mouvements de vibrations restent localisés dans une zone spatiale bien délimitée et finie. On parle donc ici d’un type de mouvement qui s’exprime principalement dans le temps. C’est le mouvement universel de toute matière solide lorsque la température est très basse.
ii) Le mouvement de rotation cohérent de tous les atomes constituants autour du centre de masse immobile (solide) ou pas (liquide). Un tel mouvement mobilise deux dimensions spatiales et une dimension temporelle. C’est le type de mouvement qui se manifeste dès que la température devient suffisamment haute. Ici, l’énergie cinétique de rotation prenne le dessus sur l’énergie potentielle responsable de l’immobilité du centre de masse. Cette dernière reste néanmoins suffisamment basse pour que les objets restent collés les uns aux autres à tout instant.
iii) Le mouvement de translation du centre de masse. Il correspond au mouvement cohérent de tous les atomes constituants dans une direction donnée. On mobilise ici une dimension spatiale et une dimension temporelle. C’est le mouvement universel de toute matière gazeuse lorsque la température devient très élevée. Ce dernier type d’état gazeux mobilise tout l’espace-temps puisqu’il peut y avoir simultanément translation, rotation et vibration des atomes constituants.
Diagramme de phases de l’eau pure
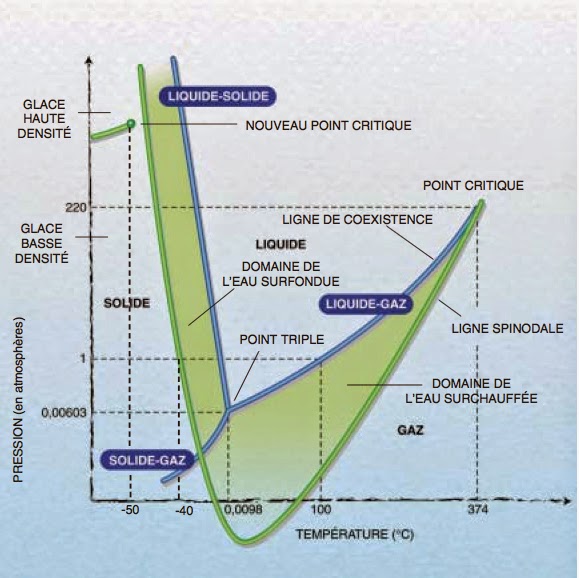
Selon ce type d’analyse, on voit que franchir le point triple signifie que les rotations deviennent possibles. Car, l’énergie cinétique devient comparable à l’énergie potentielle. Elle n’est plus négligeable comme dans le cas des solides. De même franchir le point critique signifie que les translations entrent en jeu. Cela est le signe que l’énergie potentielle ne joue quasiment plus aucun rôle face à une énergie cinétique prépondérante. On arrive ainsi à la notion de diagramme de phases. Ce dernier montre les différents domaines de coexistence des états solide, liquide et gazeux. Les variables sont généralement la pression et de la température. Celui de l’eau pure est représenté en tête de cette chronique [1].
Comme on peut le constater, le point triple de l’eau se trouve localisé à une température T = 273,16 K. Ceci correspond à une pression P = 0,61173 kPa. Le point critique se trouve quant à lui localisé à une température T = 647,1 K. Ceci correspond à une pression P = 22,06 MPa. Il découle de ceci que l’eau peut être observée à l’état liquide dans une gamme de température couvrant 374 K pour une gamme de pression s’étalant sur 22 MPa.
Autres substances
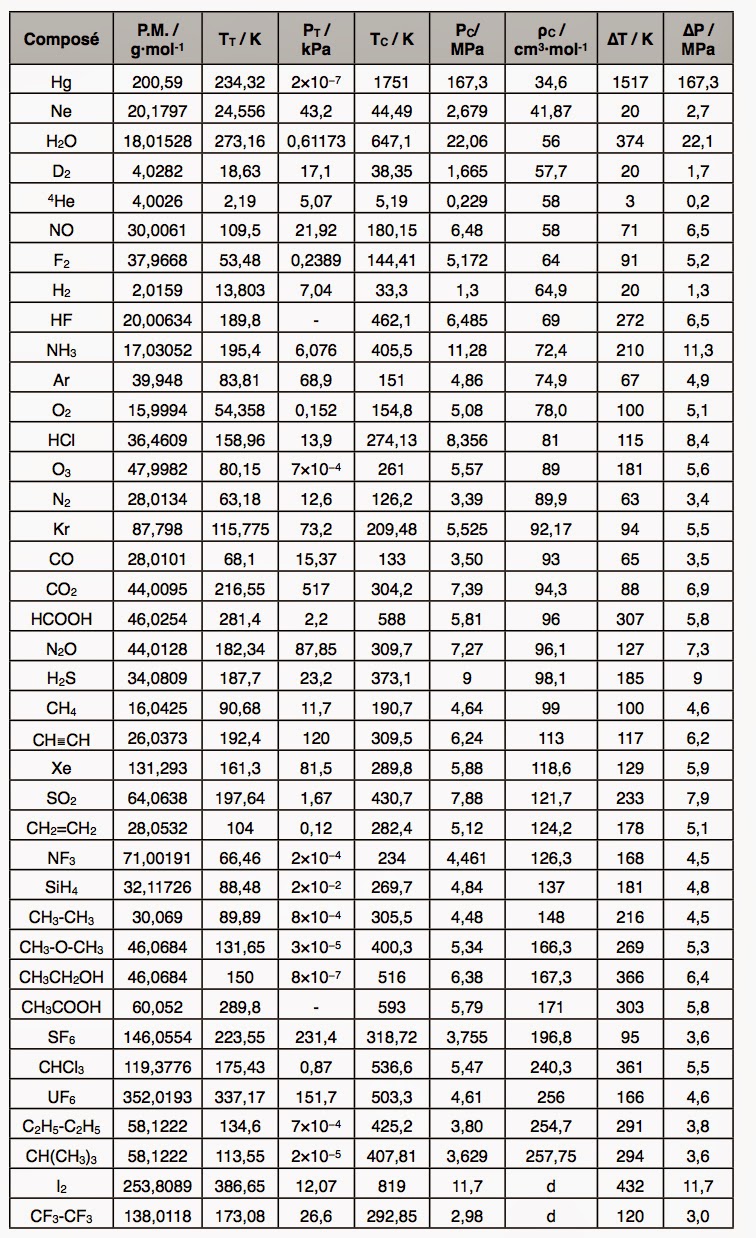
Pour mieux saisir le caractère extraordinaire de ces chiffres, on pourra se référer au tableau suivant qui compare plusieurs substances pour lesquelles il a été possible déterminer le point triple aussi bien que le point critique et que j’ai classé par ordre de densité critique ρc croissante. Cette densité critique correspond au volume critique par mole de substance au-dessus de laquelle l’état liquide ne pourra jamais apparaître par condensation. Plus ce volume critique est petit, plus les interactions potentielles entre molécules sont fortes. Ceci permet de prendre ce paramètre comme indicateur de l’énergie potentielle disponible pour un poids moléculaire donné. En effet, il existe ne règle très générale qui stipule que l’énergie potentielle d’interaction entre molécules est d’autant plus grande que le poids moléculaire est plus élevé.
Le mercure
D’après ce tableau, on constate ainsi que la substance “reine” de l’état liquide n’est pas l’eau, mais le mercure. Ceci est dû bien sûr à son poids moléculaire très élevé. Ceci provient de son caractère monoatomique. Ce dernier favorise très fortement les rotations dans une gamme de température allant de -40 °C à +1480 °C. Ce, au détriment des autres types de mouvement. Le problème du mercure, c’est qu’il rechigne à passer à l’état vapeur en raison de sa très forte énergie potentielle. Une planète qui utiliserait le mercure comme fluide transporteur serait donc pénalisée par la très haute température nécessaire pour faire circuler cet élément.
De plus, les forces potentielles ont ici pour origine le haut poids moléculaire. I faudrait donc une planète de rayon très faible. Ceci afin de ne pas générer une gravité trop forte. Car, cela mettrait un coût prohibitif pour l’élévation en hauteur de la vapeur. En raison de son rayon très faible une telle planète ne pourrait avoir d’activité tectonique propre. Cela l’obligerait à être extrêmement proche de son astre stellaire pour faire fonctionner son cycle mercuriel d’évaporation/condensation.
Le néon
Considérons donc le deuxième candidat présentant une énergie potentielle particulièrement apte à donner naissance à l’état liquide : le néon. Ici, c’est la faible masse molaire qui fait que les rotations s’activent beaucoup trop bas en température (dès -250 °C). Celles-ci sont très vite relayées (dès -230 °C) par les translations. D’où un état vapeur dans une large gamme de température et de pression. Une planète fonctionnant via un cycle au néon devrait donc être très froide et très massive. Ceci, afin de ne pas laisser le gaz s’échapper dans l’espace interstellaire.
La marge de manœuvre du liquide est ici extrêmement étroite (à peine 20 °C). Alors qu’elle était au contraire beaucoup trop vaste (1500 °C) dans le cas du mercure. Ceci amène donc à se poser la question s’il existe dans la nature une substance qui allierait la force potentielle du mercure à la faible masse moléculaire du néon. Ceci afin de produire une gamme de température optimale pour la manifestation de l’état liquide. De plus, sur une planète qui serait ni trop petite, ni trop grosse.
L’eau comme substance optimale
La réponse est bien évidemment affirmative. Et, nous sommes maintenant en mesure de comprendre en quoi la molécule d’eau est un véritable miracle de la nature. Car, l’eau possède une masse moléculaire encore plus faible que le néon. Elle arrive donc à surpasser le mercure pour le blocage des rotations moléculaires. De fait, celui-ci ne se produit pas avant 0 °C. Une fois les rotations moléculaires activées, on peut conserver le précieux état liquide. C’est-à-dire résister aux puissantes translations, jusqu’à une température record de +373 °C. Il suffit de regarder la colonne de la température du point triple TT pour comprendre le véritable tour de force que cela représente puisque seuls, l’acide acétique CH3COOH, l’hexafluorure d’uranium UF6 et l’iode I2 surpassent l’eau dans la capacité à bloquer les rotations.
Pour la capacité à bloquer les translations (colonne du point critique Tc), l’eau surpasse tous ses concurrents, à l’exception d’un seul : le mercure. On comprend donc mieux le mystère épais qui entoure cette molécule d’eau. Car, il y a un mécanisme qui donne naissance à une énergie potentielle démesurée par rapport avec la très faible masse molaire de cette molécule. Ce mécanisme à l’origine du comportement étrange de l’eau par rapport aux autres substances liquides. Il a été baptisé “liaison hydrogène” et fut remarqué dès 1919. Il se manifeste à l’échelle macroscopique par le fait spectaculaire que la glace flotte sur l’eau liquide au lieu de couler à pic.
Anomalie de densité
La glace est en effet un des rares exemples d’un solide qui est moins dense que le liquide lui ayant donné naissance. D’autres exemples de substances présentant cette caractéristique étrange sont fournis par l’arsenic, le bismuth, le gallium, et le silicium. La raison physique pour laquelle l’eau augmente son volume propre en devenant solide est un mystère qui continue à faire couler beaucoup d’encre, même de nos jours. La meilleure explication que nous ayons de ce phénomène fait appel à la théorie quantique des champs pour laquelle être “vide” ne signifie en rien être exempt de toute matière ou de tout rayonnement. Au contraire, cela signifie que dans le petit domaine d’espace-temps que l’on observe, les divers champs qui existent dans la nature sont tous dans leur état fondamental d’énergie n’étant soumis qu’aux fluctuations quantiques d’un milieu qui apparaît tantôt vide et tantôt plein…
Eau surfondue et surchauffée
Le diagramme de phase de l’eau pure montre également qu’en dehors des lignes bleues qui délimitent les états solide, liquide et gazeux de l’eau, il y a aussi les lignes vertes. Ces lignes concernent ce que l’on observe pour de l’eau ultra-pure où l’on a retiré toute impureté ou toute trace de gaz dissous. Comme on peut le constater, avec ce type d’eau il est possible de conserver l’état liquide bien en dessous de 0 °C (eau surfondue ou ultra-froide) ou bien au-dessus de 100 °C (eau surchauffée). La figure suivante montre la séquence de phase que l’on observe sous une pression de 1 atmosphère :
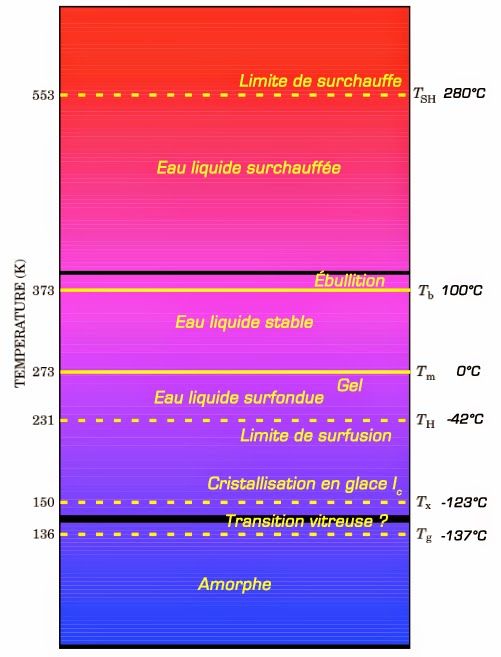
Comme on peut le voir, l’eau ultra-pure peut rester liquide dans une gamme de température allant de -42 °C à +280 °C et non de 0 °C à +100 °C comme l’expérience de tous les jours le démontre. Ceci souligne que l’eau qui coule à votre robinet n’a vraiment rien à voir avec l’eau de formule H2O. Car, cette eau contient toujours des ions et des gaz dissous qui même s’ils sont en très faible concentration modifient profondément les propriétés physiques de l’eau. Le mieux est ici de parler d’eau morphogénique.
Références
[1] José Teixeira, “L’étrange comportement de l’eau ultrafroide”, Pour la Science, juillet 2001, n° 285, pp. 84-91.
[2] P.G. de Debenedetti & H.E. Stanley, “Supercooled and glassy water”, Physics Today, june 2003, Vol. 56, pp. 40-46.


Leave a Reply