Toutes les cellules vivantes ont besoin d’entropie pour fonctionner. Elles doivent donc stocker cette entropie dans un réservoir chimique. Ceci afin de pouvoir l’utiliser au moment où l’on en aura besoin. Une molécule, appelée adénosine triphosphate (ATP), permet de faire cela au mieux. On la trouve à la concentration 1-10 mM dans la cellule [1]. Sur un plan structural, l’ATP est formée par la condensation de trois unités chimiques:
i) Une base azotée hétérocyclique appelée “adénine”.
ii) Un sucre à 5 atomes de carbone appelé “D-ribose”.
iii) Un condensat entre trois groupements phosphate.
On appelle “adénosine”, la combinaison entre la base azotée et le sucre. Une telle combinaison est représentée par la lettre ‘A’ dans l’acronyme ATP. Cette dénomination est en fait infiniment regrettable. Car, il se trouve qu’en milieu intracellulaire, l’ATP est toujours fortement associée à un atome de magnésium [2]. Occulter ce fait biologique fondamental est loin d’être la seule turpitude faite par les biologistes. Par exemple, il est très courant d’écrire la réaction de formation de l’ATP sous la forme :
ADP + Pi → ATP + H2O
Ici, le sigle “ADP” signifie adénosine diphosphate. Le symbole Pi représente l’ion hydrogéno-phosphate HPO42-. Pour quelqu’un qui ne connaît pas la biologie, ce manque de rigueur dans l’écriture est tout à fait regrettable. Car, on voit apparaître à droite de la flèche des atomes qui sont absents à gauche. Pour éviter cela, certains biologistes n’hésitent pas à carrément supprimer la molécule d’eau (!). Ils écrivent simplement :
ADP + Pi → ATP
En bon français cela s’appelle du jargon. A terme, cela aboutit à ce que les biologistes et les médecins raisonnent sur des espèces fictives complètement déconnectées de la réalité. On ne voit plus que pour faire la synthèse de l’ATP il faut impérativement éliminer une molécule d’eau. On ne voit pas que le magnésium est toujours présent tout au long de la réaction. De plus, on oublie que des espèces porteuses d’une charge électrique non nulle ne peuvent exister que dans l’eau. Après cela, étonnez-vous que la biologie devienne une science anhydre… C’est la raison pour laquelle, je déconseille formellement l’emploi du sigle “ATP” dans un bilan chimique.
Je préconise plutôt de réserver cet acronyme pour le texte. Car même les Grecs de l’antiquité connaissaient la devise : Rien ne se perd, rien ne se crée, tout se transforme. Pour ceux qui partagent ce point de vue, je leur conseille d’écrire l’ATP dans les bilans chimiques sous la forme MgAP3O92-. On fait ici clairement apparaître qu’il s’agit d’une espèce de charge négative. De plus, que cette charge électrique est partiellement neutralisée par un ion Mg2+. Par conséquent, une telle espèce n’existe que parce qu’il y a de l’eau dans toute cellule. La lettre ‘A’ est comme d’habitude l’abréviation du mot “adénosine”. Toutefois, au lieu des lettres T et P, il est important de souligner qu’il y a 3 atomes de phosphore reliés par des atomes d’oxygène. Muni de cette convention, la réaction de formation de l’ATP devient :
MgHAP2O6 + HPO42- → MgAP3O92- + H2O
On remarquera que la réaction est maintenant équilibrée. Ceci, aussi bien en nombre d’atomes, qu’en charge électrique. Voilà un minimum de rigueur pour tout scientifique qui se respecte. Ceci est évidemment correct si l’on raisonne de manière classique. En physique quantique, il faudrait également rajouter l’information de spin. On devrait donc en toute rigueur écrire :
1MgHAP2O6 + 1HPO42- → 1MgAP3O92- + 1H2O
On fait ainsi clairement apparaître que la réaction ne fait intervenir que des singulets de spin. C’est-à-dire des espèces non radicalaires. La réaction se trouve donc être autorisée de spin. Voici maintenant sous une forme encore plus développée, la structure chimique de cette molécule. Car, il s’agit de comprendre son rôle crucial en biologie et le fait qu’elle ne peut exister que dans l’eau. J’utilise ici le formalisme de Lewis qui fait intervenir des paires d’électrons. Soit V le nombre total de paires. Elles se répartissent en trois groupes :
i) Liaisons simples symbolisées par la lettre grecque σ.
ii) Liaisons multiples symbolisées par la lettre grecque π.
iii) Doublets non partagés symbolisés par la lettre grecque λ.
Les éléments p comme le carbone, l’azote, l’oxygène et le phosphore suivent la règle stricte de l’octet. Par contre, le magnésium qui est un élément s, échappe à cette règle. Il forme plutôt une liaison ionique. Une telle liaison ne suit pas la règle de l’octet “covalent”. On considère plutôt qu’il donne ses deux électrons aux autres éléments p. Sur un plan stœchiométrique, l’ATP est un composé de formule brute C10H12N5P3O13. Si l’on omet l’ion magnésium Mg2+, l’ATP véhicule 4 charges négatives. Le nombre total de paires d’électrons vaut donc :
V = [1×12 + 4×10 + 5x(5+3) + 6×14 + 4]/2 = 87
Sur un plan structural, l’ATP comporte c = 3 cycles pour q = 10 + 5 + 3 + 13 = 31 atomes “lourds” et h = 12 atomes d’hydrogène. Le nombre de liaisons simples vaut donc:
σ = h + q + c – 1 = 12 + 31 + 3 – 1 = 45
Le nombre d’insaturations autorisé dans le cadre de la règle stricte de l’octet vaut :
V + c = 3q + 1 – π ⇒ π = 3×31 + 1 – 87 – 3 = 94 – 90 = 4
Enfin le nombre de paires non partagées vaut:
λ = V – σ – π = 87 – 45 – 4 = 87 – 49 = 38
Le résultat est représenté ci-dessous:
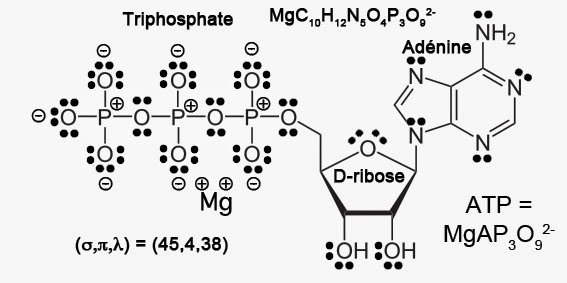
On remarquera que je n’ai pas fait apparaître de double liaisons entre les atomes de phosphore et d’oxygène. En effet, sur un plan quantique, il est criminel de faire apparaître une double liaison qui en fait n’existe pas. Car, les calculs montrent que les plus fortes contributions aux liaisons chimiques proviennent du phosphore. Or, ce dernier utilise une orbitale 3s et trois orbitales notées (3px, 3py, 3pz). Le calcul montre aussi que la contribution des cinq orbitales 3d du phosphore est négligeable. Chaque atome de phosphore se trouve donc bien engagé dans quatre liaisons chimiques fortes. Il y a donc des doublets électroniques non-liants sur les atomes d’oxygène associés aux charges formelles négatives.
On pourrait de fait annihiler chaque charge négative (doublet non-liant) sur l’atome d’oxygène avec la charge positive correspondante sur les atomes de phosphore centraux. Ceci afin de faire apparaître (formellement) une double liaison P=O. Cette pratique se retrouve dans de nombreux ouvrages d’enseignement. Elle tend à faire croire qu’il existe trois liaisons phosphore-oxygène beaucoup plus stables que les autres liaisons. Or, ceci n’est pas le cas. En effet, il existe une résonance quantique entre structures indiscernables. Dans le cas de l’ATP, toutes les liaisons P-O sont de même nature. Il n’y en a pas certaines plus stables que les autres. Ceci est clairement évident dans la figure ci-dessus.
Par contre, cela l’est beaucoup moins dans la représentation suivante tirée de Wikipédia. On remarquera que l’atome de magnésium a disparu. Il se trouve remplacé par des atomes d’hydrogène “fictifs”. Ceci, afin d’avoir une structure moléculaire neutre qui n’a plus besoin d’eau pour exister. En fait il se trouve que l’ATP est un acide fort, entièrement dissocié en milieu aqueux. On notera aussi la présence de trois double liaisons P=O. Elles aussi sont complètement fictives. Comment comprendre ce qui se passe réellement dans une cellule si l’on n’arrête pas d’écrire des espèces fictives…
En avons-nous vraiment fini avec l’ATP ? Pas vraiment. Car nous avons parlé de la conservation de la masse, de la charge et du spin. Nous n’avons encore rien dit sur l’aspect entropie. Car, ici le problème se complique vraiment. En effet, la plupart des ouvrages de biologie prétendent que la molécule d’ATP sert à stocker de l’énergie. Ce faisant, on zappe sans vergogne le mot “libre” systématiquement associée au mot “énergie”. Car, tout thermodynamicien qui se respecte sait qu’une énergie libre n’est pas une énergie. C’est plutôt un contenu entropique qui se manifeste à une température T donnée. Pour ceux qui auraient des doutes, j’ai analysé cela en détail [3]. La confusion provient du fait que le produit d’une entropie par une température possède la dimension d’une énergie.
Toutefois, alors que l’énergie se conserve, l’entropie, elle, ne peut qu’augmenter. Il convient donc d’être prudent et d’appeler les choses par leur nom. Ainsi, ce que l’on appelle “énergie libre” est bien fondamentalement une entropie. Car une telle notion sert à connaître le sens d’une évolution spontanée : ∆G = ∆H – T·∆S < 0. On voit ici apparaître très clairement le caractère entropique de toute “énergie libre” via le terme -T·∆S. Ce terme regroupe de fait, toutes les variations d’entropie au sein du système lui-même. Quant au terme, enthalpique ∆H, il correspond lui aussi à une variation d’entropie. Il s’agit ici de comptabiliser tous les échanges d’entropie avec l’extérieur de ce même système. L’ATP est donc bien un réservoir d’entropie et en aucun cas non un réservoir d’énergie.
Considérons la réaction d’hydrolyse de l’ATP qui correspond à l’inverse de sa synthèse :
MgAP3O92- + H2O → MgHAP2O6 + HPO42-
La valeur la plus souvent citée dans les livres de biologie pour la variation d’énergie libre ∆G est ΔG = -30,5 kJ·mol-1. Le problème est que cette valeur ne tient pas compte de la chaleur de neutralisation de l’ion phosphate libéré par l’eau. Ceci fait que l’énergie libre disponible via l’hydrolyse de l’ATP n’est en fait de -25 kJ·mol-1 [4]. Autrement dit, on récupère de l’entropie dès que l’on casse cette molécule. Cela signifie bien sûr qu’il faut réduire localement l’entropie pour la fabriquer. Il faut donc disposer d’une source de basse entropie qui peut être soit de nature électrochimique (respiration), soit de nature photochimique (photosynthèse).
Dans la respiration cellulaire, la cellule utilise le fait qu’il existe toujours un potentiel membranaire ΔV. Celui-ci provient de la répartition inégale d’ions de part et d’autre de la membrane lipidique. Ainsi, on peut à tout moment annuler ces différences de concentration de part et d’autre d’une bicouche lipidique. Ce faisant, on récupère l’entropie nécessaire pour fabriquer l’ATP, selon la relation : ΔG(kJ·mol-1) = 96,5xΔV(mV). Pour une valeur moyenne ΔV = -60 mV, on récupère donc environ -6 kJ·mol-1 par charge électrique, positive ou négative. Pour la synthèse de l’ATP ceci nécessite de faire passer 4 protons pour obtenir une molécule d’ATP. En toute rigueur, la synthèse de l’ATP doit donc être écrite :
MgHAP2O6 + HPO42- + 4 H+ext → MgAP3O92- + H2O + 4 H+int
Les indices “ext” et “int” font ici référence à l’existence d’une membrane étanche au passage spontané des protons. Ceci empêche de les simplifier à droite et à gauche, comme ce serait évidemment le cas en solution. Le fait d’écrire MgAP3O92- pour la formule de l’ATP, implique aussi que l’ADP doit s’écrire MgHAP2O6. On remarquera alors qu’il n’y a plus de charges négatives dans l’ADP. Concrètement, cela signifie que l’ADP recherchera plutôt les milieux lipophiles. Par contraste, l’ATP de charge négative ne peut exister que dans un milieu aqueux. Ceci nous montre que lors de la transformation de l’ATP en ADP, il y a bien sûr accroissement d’entropie. Toutefois, il y a perte d’un grand nombre de molécules d’eau suite à la migration du résidu ADP vers un milieu plus lipophile.
Toute poche protéique où se produit une transformation d’ADP en ATP ou réciproquement devra donc se déformer très fortement. Ceci provoquera un ébranlement complet de toutes les protéines en contact avec la protéine où se produit la transformation. Cette simple observation découle d’une écriture correcte des espèces chimiques mises en jeu. Elle devient fondamentale dans le cas du moteur actine-myosine par exemple. Voici d’ailleurs une animation de ce processus fondamental pour toute contraction musculaire :
Enfin, il existe également une autre manière de casser la molécule d’ATP. Il s’agit ici de former un ion pyrophosphate et une molécule d’adénosine monophosphate (AMP).
MgAP3O92- + H2O → MgP2O72- + AH2PO3
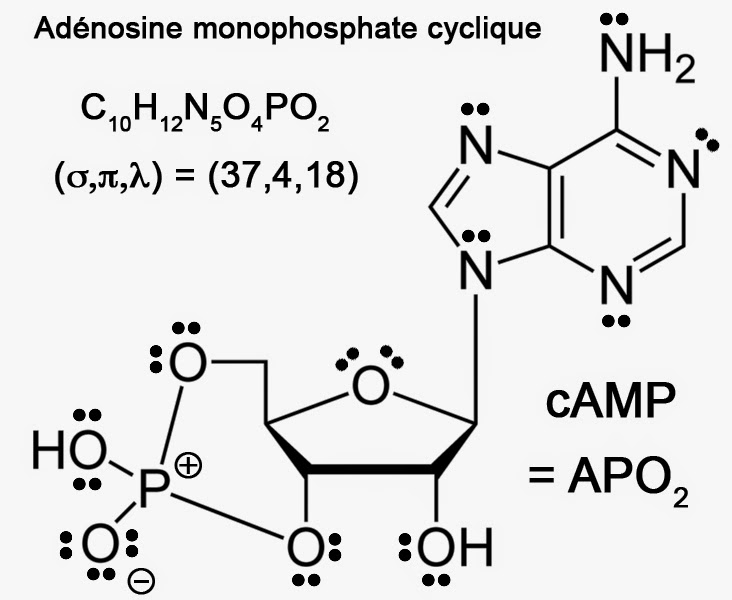
Par conséquent, l’AMP doit être écrite AH2PO3 soulignant sa nature lipophile comme l’ADP. Cette écriture présente l’avantage de mettre en évidence la possibilité d’une déshydratation intramoléculaire pouvant conduire à l’AMP cyclique (cAMP) de formule formulée APO2 :
AH2PO3 → APO2 + H2O
On sait que cet AMP cyclique est un messager second pour tout ce qui concerne l’action des hormones ou des neurotransmetteurs. Sur un plan stœchiométrique, l’AMP cyclique est un composé neutre de formule brute C10H12N5PO6. Il présente un nombre total de paires d’électrons :
V = [1×12 + 4×10 + 5x(5+1) + 6×6]/2 = 118/2 = 59
L’AMP cyclique comporte aussi c = 4 cycles pour q = 10 + 5 + 1 + 6 = 22 atomes “lourds” et h = 12 atomes d’hydrogène. Le nombre de liaisons simples vaut donc :
σ = h + q + c – 1 = 12 + 22 + 4 – 1 = 37
Le nombre de liaisons multiples autorisé dans le cadre de la règle stricte de l’octet n’a pas changé :
V + c = 3q + 1 – π ⇒ π = 3×22 + 1 – 59 – 4 = 67 – 63 = 4
Enfin le nombre de paires non partagées vaut: λ = V – σ – π = 59 – 37 – 4 = 59 – 41 = 18
Voici donc sa représentation conforme à la règle stricte de l’octet.
Références
[1] Beis I & Newsholme EA (1975). “The contents of adenine nucleotides, phosphagens and some glycolytic intermediates in resting muscles from vertebrates and invertebrates”. Biochem. J., 152 (1): 23–32.
[2] Storer A & Cornish-Bowden A (1976). “Concentration of MgATP2− and other ions in solution. Calculation of the true concentrations of species present in mixtures of associating ions”. Biochem. J., 159 (1): 1–5.
[3] Marc Henry, ““Thermodynamics of life”, Substantia (2021), Accepted: 2020-08-26 | Published Online: 2020-08-26 | DOI: 10.36253/Substantia-959.
[4] Podolsky RJ & Morales MF (1995), «The enthalpy change of adenosine triphosphate hydrolysis», J. Biol. Chem., 218, 945-959.



Leave a Reply