Notre première notion intuitive et subjective de température provient de la sensation de froid et de chaud. La science a su transformer cette sensation de nature qualitative en une notion quantitative parfaitement définie. Une telle notion s’applique bien au-delà de notre expérience directe et sensible de la matière. Par exemple, il est courant d’entendre dire que tel système de spins se trouve à une température de 2,51 kelvins. Ou bien encore que la température qui règne au centre du soleil est de 20 millions de kelvins. Or, il n’existe aucun moyen de toucher un système de spins ou d’aller au centre du soleil pour y mesurer la température régnante. Ceci est physiquement impossible.
Le premier contact avec la thermodynamique a très probablement eu lieu lorsque les hommes ont constaté que des objets exposés aux rayons du soleil ou placés auprès d’un feu avaient un comportement différent de ceux placés à l’ombre ou loin du feu. La même observation pouvait être faite en comparant un être vivant et un corps inanimé. En thermodynamique, on se confronte à des changements d’états comme l’ébullition ou la congélation. Ou bien encore comme la cuisson de la viande. Petit à petit, la notion de chaleur s’imposa comme étant la responsable des changements d’état observés pour des gaz, des liquides et des solides.

La thermodynamique est donc la science des forces (δύναμος ou dynamos en grec) liées à la chaleur (θέρμος ou thermos en grec). Il s’agit d’une science fondamentale qui s’est construite essentiellement au XIXᵉ siècle. Plus que toute autre science, la thermodynamique a tout de suite donné naissance à de multiples paradoxes. La plupart tournent autour du second principe lié à la nature de l’irréversibilité. L’existence de ces paradoxes montre que la thermodynamique est une science qui touche à la racine même des choses. Ceci nécessite de l’aborder avec la plus grande rigueur logique.
Certains présentent la thermodynamique en posant des axiomes de base. Ensuite, on manipule toute une série de formules impliquant des dérivées partielles. Cette approche est celle de la plupart des manuels d’enseignement. C’est bien évidemment la dernière chose à faire. La meilleure manière d’aborder la thermodynamique est de faire la part des choses. Car, il y a d’une part ce qui peut être déduit des lois connues de la mécanique et de l’électrodynamique. D’autre part, il y a ce qui ne peut être déduit que d’observations expérimentales.
Un système thermodynamique est un ensemble de corps placés dans un environnement donné. L’exemple le plus simple est un certain volume de gaz. On a l’habitude de distinguer trois grand types de systèmes thermodynamiques :
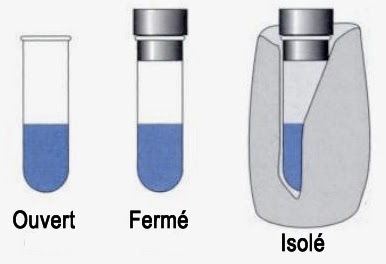
Les systèmes ouverts peuvent échanger matière et chaleur avec l’extérieur. Les systèmes fermés ne peuvent échanger pour leur part que de la chaleur. Enfin, les systèmes isolés ne peuvent échanger ni matière ni chaleur. L’état thermodynamique d’un système est spécifié en mesurant certaines propriétés physiques macroscopiques. Les principaux sont la température, le volume ou la pression. À ce stade, il est important de faire la distinction entre un système thermodynamique et un système physique.
Ainsi, si je prends de la vapeur d’eau, je peux étudier son comportement en fonction de la température T et de la pression p, soit. Je peux aussi considérer son comportement en fonction de la température T et du volume V. Dans ce cas j’ai donc deux systèmes thermodynamiques différents eau = f(T,P) et eau = f(T,V) pour le même système physique : la vapeur d’eau. Ce qui distingue la thermodynamique des autres sciences, c’est que la température est toujours un paramètre pertinent du problème.
La conséquence logique est que la notion de système thermodynamique est une notion anthropomorphique liée à l’expérimentateur. Car c’est bien lui qui choisit quelles variables macroscopiques il va considérer. Bien évidemment, tous les systèmes thermodynamiques se valent. Il n’y en a pas un de plus « correct » que les autres. Par contre, tous ne sont pas équivalents sur le plan pratique. On notera le parallèle frappant avec les systèmes quantiques. Car, là aussi l’observateur joue un rôle déterminant dans le choix des observables qu’il va mesurer, via la notion d’ECOC. Ceci nous montre que la thermodynamique est probablement la science la plus proche de la mécanique quantique sur le plan conceptuel.
De fait, comme la mécanique quantique, la thermodynamique se base sur des axiomes de travail. Ces axiomes sont absolument nécessaires pour développer une argumentation logique. Ils ne trouvent leur justification que dans la possibilité de rendre compte de manière qualitative et quantitative des faits expérimentaux observés. En thermodynamique, ces lois ou principes sont au nombre de quatre. La loi la plus fondamentale est d’ailleurs de nature qualitative plutôt que quantitative. C’est la raison pour laquelle on l’appelle principe zéro.
La thermodynamique n’existerait pas non plus sans son premier principe. C’est ce principe qui permet d’opérer une claire distinction entre les notions de température et de chaleur. Au début, on pensait que la chaleur ou le calorique était une sorte de fluide comme l’électricité ou le magnétisme. Puis on découvrit que chaleur et travail pouvaient se transformer l’un dans l’autre. Cela donna naissance au premier principe de la thermodynamique, avec deux notions fondamentales : l’énergie cinétiques source de chaleur et l’énergie potentielle, source de travail.


Leave a Reply