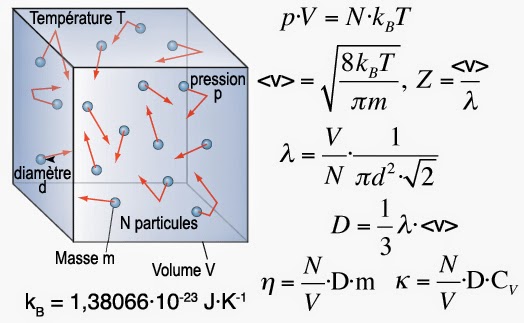
La théorie cinétique des gaz est un modèle physique qui permet de comprendre ce qui se passe à l’échelle microscopique alors que l’on ne dispose que d’appareils macroscopiques pouvant mesurer le volume, la température ou la pression.
Vitesse moyenne d’une molécule d’eau
L’eau par exemple possède une masse molaire M = 18 g·mol-1, ce qui signifie que la masse d’une molécule vaut m(H2O) = M/NA où NA = 6,0221413·1023 mol-1 représente le nombre d’Avogadro relié à la constante des gaz parfaits R = NA·kB = 8,3144621 J·mol-1·K-1. On trouve ainsi que dans son état vapeur à T = 373,15 K (100 °C) la molécule d’eau possède une vitesse moyenne <v> = 663 m·s-1≈ 2400 km·h-1. Ceci donne une idée assez claire de ce que l’on appelle l’« agitation moléculaire » et montre que les molécules d’eau se comportent comme de véritables petits bolides qui passent leur temps à jouer aux autos tamponneuses.
Libre parcours moyen d’une molécule d’eau
Pour pouvoir estimer la distance parcourue entre deux chocs appelée “libre parcours moyen”, il faut tout d’abord estimer le coefficient de diffusion D qui correspond à la surface explorée par la molécule par unité de temps. Ainsi, sachant qu’une mole de vapeur d’eau occupe un volume VM(100 °C, 101,325 kPa) = 0,030143 m3·mol-1, la densité ρ = NA·m/V de la vapeur d’eau vaut : ρ(100 °C, 101,325 kPa) = 6,0221367·1023⨯2,9907243·10-26/0,030143 = 0,5975 kg·m-3. Maintenant, la viscosité de cette même vapeur d’eau vaut η(100 °C, 101,325 kPa) = 12,3 µPa·s, soit un coefficient de diffusion D = η/ρ = 2,06·10-5 m2·s-1. Le libre parcours moyen d’une molécule d’eau à l’état vapeur vaut donc λ = 3⨯2,06·10-5/662,3 = 9,33·10-8 m = 933 Å, valeur voisine de la centaine de nanomètres.
Taille d’une molécule d’eau et fréquence des collisions
Pour mieux saisir ce que cela signifie évaluons le volume d’une molécule à partir de la densité de l’eau liquide ρ ≈ 1 g·cm-3, où l’on sait que les molécules sont collées les unes aux autres. Dans ces conditions le volume molaire vaut VM = M/ρ = 18 cm3·mol-1, et chaque molécule occupe donc un volume v = VM/NA ≈ 30·10-24 cm3 = 30 Å3. Or, l’on sait aussi qu’un empilement aléatoire dense de sphères génère entre 35,9 et 37,5% de vide, c’est-à-dire que la matière n’occupe que 62,5 à 64,1% du volume disponible. Considérant un coefficient d’empilement moyen de 63,3%, il en découle que le diamètre d’une molécule d’eau isolée est d = (6⨯30⨯0,633/π)1/3= 3,31 Å.
On peut ainsi constater qu’une molécule d’eau qui vient de subir une collision avec une autre molécule parcourt en moyenne une distance égale à 280 fois son diamètre avant d’entrer en collision avec une autre molécule. Une autre manière permettant d’illustrer le chaos moléculaire qui règne dans la vapeur d’eau est de calculer la fréquence des collisions Z = <v>/λ = 663/9,33·10-8= 7·109 chocs par seconde.
Diamètres de collision de la molécule d’eau
Il est également intéressant d’estimer le diamètre de collision de la molécule d’eau à partir du libre parcours moyen :
d_{choc} = \sqrt {\frac{{{V_M}}}{{{N_A}\cdot\lambda \cdot\pi \sqrt 2 }}} = \sqrt {\frac{{0,030143}}{{6,0221413\times {{10}^{23}}\times 9,33\times {{10}^{ - 8}}\times\pi\sqrt 2 }}} = 3,48\cdot{10^{ - 10}} mOn trouve ainsi d = 3,48 Å, valeur du même ordre de grandeur que le diamètre (3,33 Å) calculé à partir de la densité du liquide. Une autre manière d’accéder au diamètre de collision consiste à partir de la conductivité thermique de la vapeur d’eau κ(100 °C, 101,325 kPa) = 0,025 W·m-1·K-1. La capacité calorifique à volume constant de l’eau vapeur étant CV = 28,03 J·mol-1·K-1, on peut calculer un nouveau coefficient de diffusion :
D_{th} = \frac{{\kappa\cdot{V_M}}}{{{C_V}}} = \frac{{0,025\times 0,030143}}{{28,03}} = 2,69\cdot{10^{ - 5}} {m^2}\cdot{s^{ - 1}}Le libre parcours moyen thermique vaut donc λth = 3⨯2,69·10-5/663 = 1,216·10-7 m = 1216 Å, soit un diamètre de collision :
d_{th} = \sqrt {\frac{{{V_M}}}{{{N_A}\cdot\lambda_{th}\cdot\pi\sqrt 2 }}} = \sqrt {\frac{{0,030143}}{{6,0221413\times {{10}^{23}}\times 1,216\times {{10}^{ - 7}}\times\pi\sqrt 2 }}} = 3,04\cdot{10^{ - 10}} mCohérence de la théorie atomique
Ceci montre que la molécule apparaît légèrement plus petite lors d’un transfert de chaleur (conductivité thermique) que lors d’un transfert de quantité de mouvement (viscosité). La taille moyenne de collision ([3,04 + 3,48]/2 = 3,26 Å) est pour sa part assez proche de la taille géométrique (3,31 Å) au centième de nanomètre près. Tout ceci démontre la grande cohérence de la théorie atomique de la matière puisque l’on arrive au même ordre de grandeur de taille à partir de 3 mesures foncièrement différente: densité, viscosité et conductivité thermique.


Leave a Reply