Les feldspaths
Les feldspaths (KAlSi3O8– NaAlSi3O8– CaAl2Si2O8) sont un groupe de minéraux trouvés dans la plupart des roches. Ils forment jusqu’à 60% de la croûte terrestre. Les feldspaths cristallisent à partir du magma sous la forme de veines au sein de roches ignées. Ces roches peuvent être de type plutonique, c’est-à-dire formées en profondeur comme le granite. Elles peuvent aussi être volcaniques, car formées en surface comme le basalte. On en trouve également dans beaucoup de roches métamorphiques formées par recristallisation de roches sédimentaires.
Les feldspaths appartiennent à la famille des tectosilicates. Ce sont des structures tétraédriques où chaque tétraèdre MO4 (M = Si, Al) partage ses 4 quatre sommets avec quatre autres tétraèdres MO4. Considérons un granite contenant 74,5% de silice SiO2 ; 14% d’alumine Al2O3 ; 9,5% d’oxydes alcalins (Na2O ou K2O) et 2% d’oxydes d’ions alcalino-terreux (Ca,Mg)O ou de métaux de transition (Fe,Mn)O,. Deux grands types de réactions peuvent conduire aux feldspaths :
6 SiO2+ Al2O3+ (Na,K)2O → 2 (Na,K)[AlSi3O8]
2 SiO2+ Al2O3+ (Ca,Mg,Fe,Mn)O → (Ca,Mg,Fe,Mn)[Al2Si2O8]
Pour les feldspaths alcalins, on peut identifier l’orthoclase et la sanidine de formule K[AlSi3O8] ainsi que l’albite de formule Na[AlSi3O8]. Pour les feldpsaths alcalino-terreux le principal est l’anorthite Ca[Al2Si2O8] qui forme, par mélange avec l’albite, la série des plagioclases Ca1-xNax[Al2-xSi2+xO8] .
Les micas
L’altération en surface par l’eau et les acides humiques (plantes) des feldspaths conduit aux micas selon le bilan :
3 K[AlSi3O8] + 2 H+ + 12 H2O → KAl2[AlSi3O10](OH)2+ 2 K+ + 6 Si(OH)4
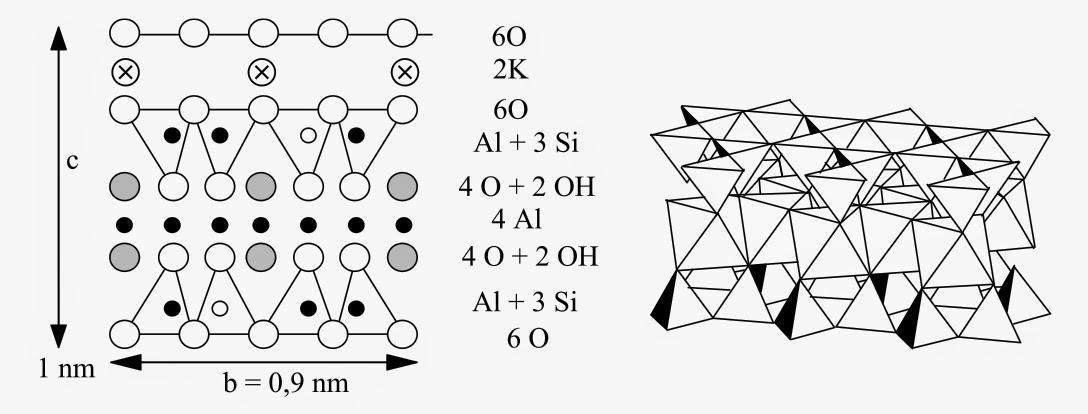
Comme le montre la figure ci-dessus, les micas sont formés d’une couche octaédrique Al(OH)3 prise en sandwich entre deux couches tétraédriques Si2O3(OH)2. La substitution (Si ↔ Al) en site tétraédrique impose alors la présence d’ions potassium intercalés entre les feuillets. Il existe toute une famille de micas par substitution (K ↔ Li, Na, Ca) et (Al ↔ Mg, Fe) :
Muscovite : KAl2[AlSi3O10](OH)2
Paragonite : NaAl2[AlSi3O10](OH)2
Margarite : CaAl2[Al2Si2O10](OH)2
Phlogopite : KMg3[AlSi3O10](OH,F)2
Illite : K(Mg3-xFex)[AlSi3O10](OH)2·H2O
Biotite : K(Mg,Fe)3[AlSi3O10](OH,F)2
Zinnwaldite : KLiFe[AlSi3O10](OH,F)2
Lépidolites : KLi2-xAl1+x[Al2xSi4-2xO10](OH,F)2
Argiles 1/1
Les micas peuvent à leur tour être altérés toujours via l’eau et les acides humiques (forêts de conifères, latérites, podzols) pour donner naissance aux argiles 1/1 :
2 KAl2[AlSi3O10](OH)2 + 2 H+ + 3 H2O → 3 Al2[Si2O5](OH)4 + 2 K+
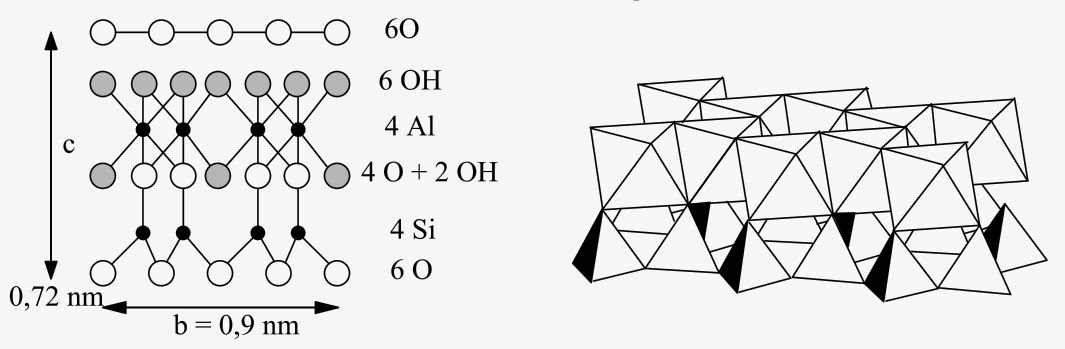
Cette structure est dite de type 1/1, car elle est formée d’un feuillet tétraédrique condensé avec un feuillet octaédrique. Elle est à la base de kaolinites Al2[Si2O5](OH)4 utilisées pour fabriquer la porcelaine. On la retrouve aussi comme charge minérale dans les papiers, les caoutchoucs ou les peintures. Par insertion d’une monocouche dans le gap de van der Waals de la kaolinite, on obtient l’halloysite Al2[Si2O5](OH)4·2H2O, caractérisée par un désordre turbostratique au niveau de l’empilement des feuillets. Les deux atomes d’aluminium du feuillet octaédrique peuvent aussi être remplacés par trois atomes divalents pour former les serpentines (Mg,Fe)3[Si2O5](OH)4 :
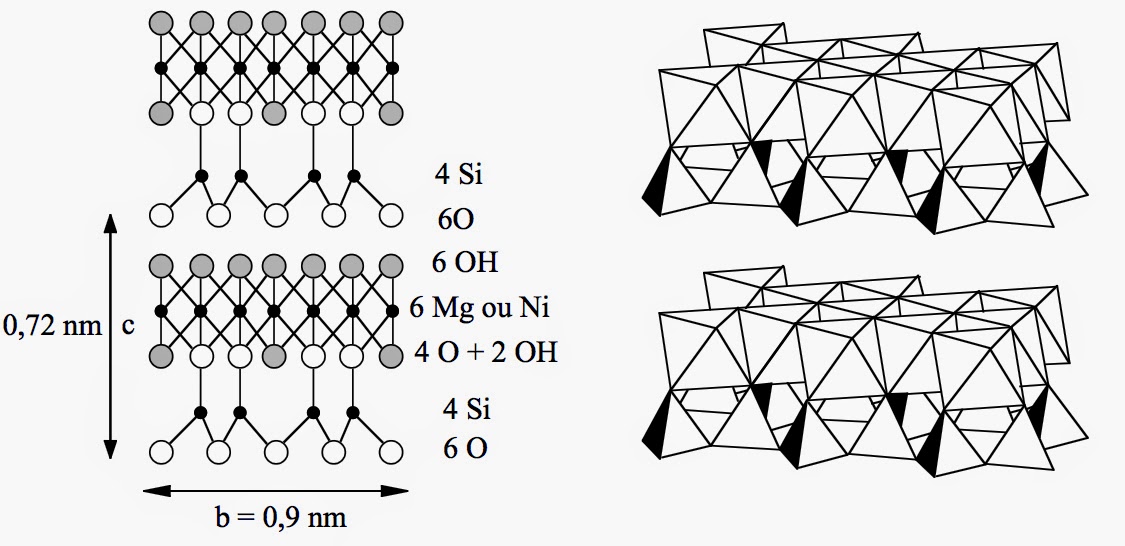
Les garniérites
Par substitution (Fe ↔ Ni), on obtient les garniérites de belle couleur verte. En raison de l’asymétrie du feuillet argileux, tétraédrique d’un côté et octaédrique de l’autre, il existe une tension structurale dans les serpentines. Celle-ci peut conduire à l’enroulement du feuillet sur lui-même. On aboutit alors à la forme fibreuse de type chrysotile que l’on retrouve dans l’amiante blanche :
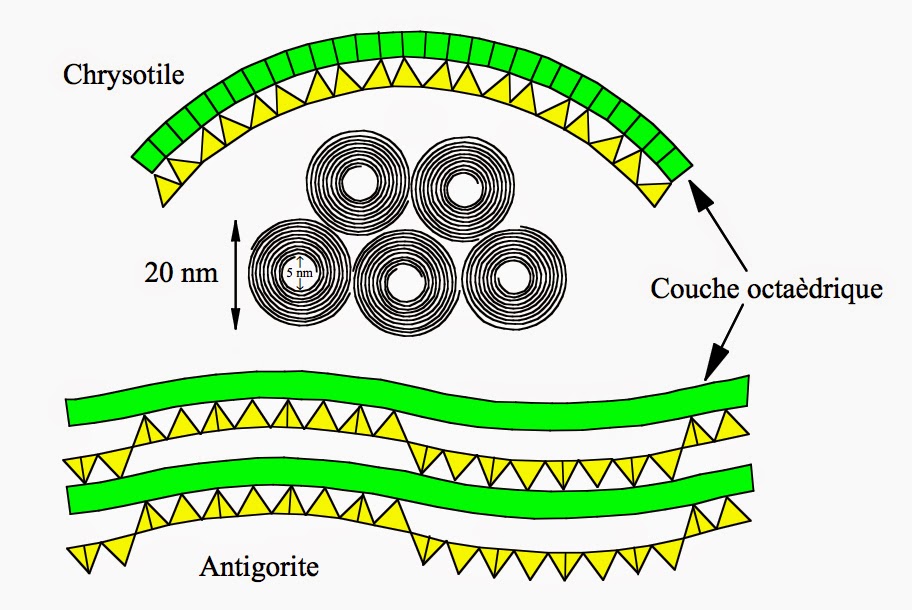
L’enroulement peut être évité en inversant de temps en temps l’orientation des tétraèdres. Ceci conduit alors à la forme lamellaire de type antigorite, forme courante de serpentine utilisée en sculpture et en joaillerie.
Le talc
L’altération des feldspaths peut aussi conduire à des argiles neutres de type 2/1 selon le bilan :
2 K[AlSi3O8] + 2 H+ + 4 H2O → Al2[Si4O10](OH)2 + 2 K+ + 2 Si(OH)4
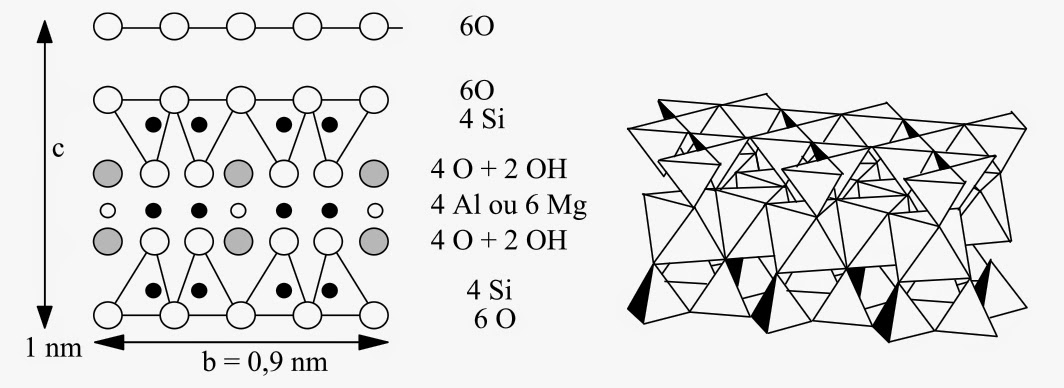
On obtient ainsi la pyrophyllite Al2[Si4O10](OH)2 qui, par substitution (2 Al ↔ 3 Mg), donne le talc Mg3[Si4O10](OH)2. Ici aussi, différentes substitutions donnent naissance à une grande variété d’argiles de type (2/1) :
Smectites : Al2[Si4O10](OH)2·nH2O (n = 0, ∞)
Montmorillonites : NaxAl2[AlxSi4-xO10](OH)2·2H2O
Saponites : NaxMg3[AlxSi4-xO10](OH)2·2H2O
Vermiculites : (Mg,Ca)x(Mg,Fe)3-x[AlSi3O10](OH)2·2H2O
Les sols argileux riches en illites et en smectites
Les prairies et les chernozem se forment ainsi sur des sols argileux riches en illites et en smectites. La vermiculite est pour sa part employée dans les emballages puisqu’en la chauffant à 300°C elle peut multiplier son volume par 20 aboutissant à un matériau de très faible densité (ρ = 0,09 g·cm-3). La montmorillonite aurait quant à elle pu abriter les tous premiers ribozymes auto-réplicants sur une terre abiotique.
L’existence d’un gap de van der Waals neutre dans les argiles (1/1) ou (2/1) permet d’insérer toute molécule neutre de nature organique ou minérale. On peut ainsi très bien insérer dans le gap d’une argile (2/1) un mono-feuillet M(OH)2 où M est tout cation divalent :
3 M(OH)2+ M2Al[AlSi3O10](OH)2 → M5Al[AlSi3O10](OH)8
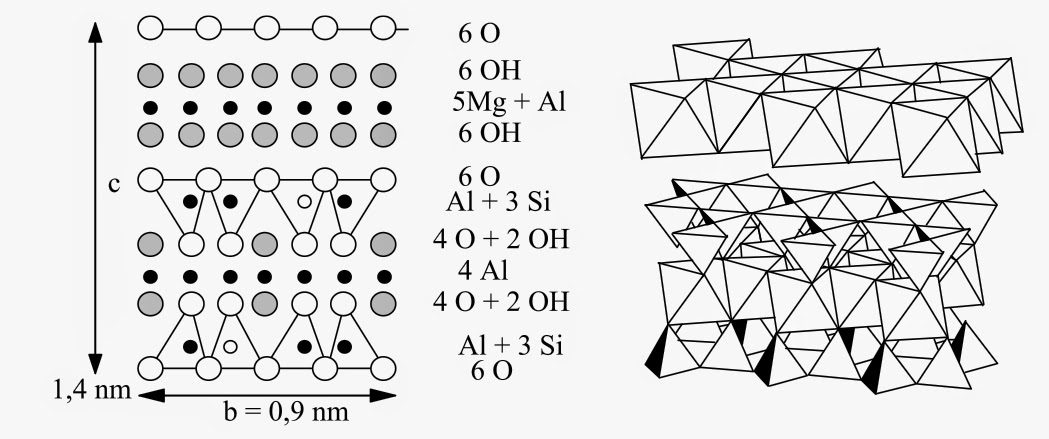
On obtient ainsi les structures chlorites, argiles de type (2/1/1) avec des phases comme le clinochlore (Mg,Fe)5Al[AlSi3O10](OH)8 ou la pennantite Mn5Al[AlSi3O10](OH)8. Les terres agricoles ou les sédiments marins sont ainsi des mélanges de chlorites et d’illites.
Hydroxydes lamellaires
Enfin, l’altération ultime des chlorites conduit à des hydroxydes lamellaires et de la silice selon le bilan :
M5Al[AlSi3O10](OH)8 + 10 H2O → 2 Al(OH)3+ 3 Si(OH)4+ 5 M(OH)2


Leave a Reply