La description du mouvement des électrons au voisinage d’un noyau comprenant 8 protons (atome d’oxygène) et de deux noyaux ne possédant qu’un seul proton (atome d’hydrogène) ne peut se faire qu’au moyen des lois de la physique quantique. Le calcul de l’énergie électronique totale associée à cet ensemble de 10 charges positives entourées d’un nuage électronique de 10 électrons est relativement complexe.
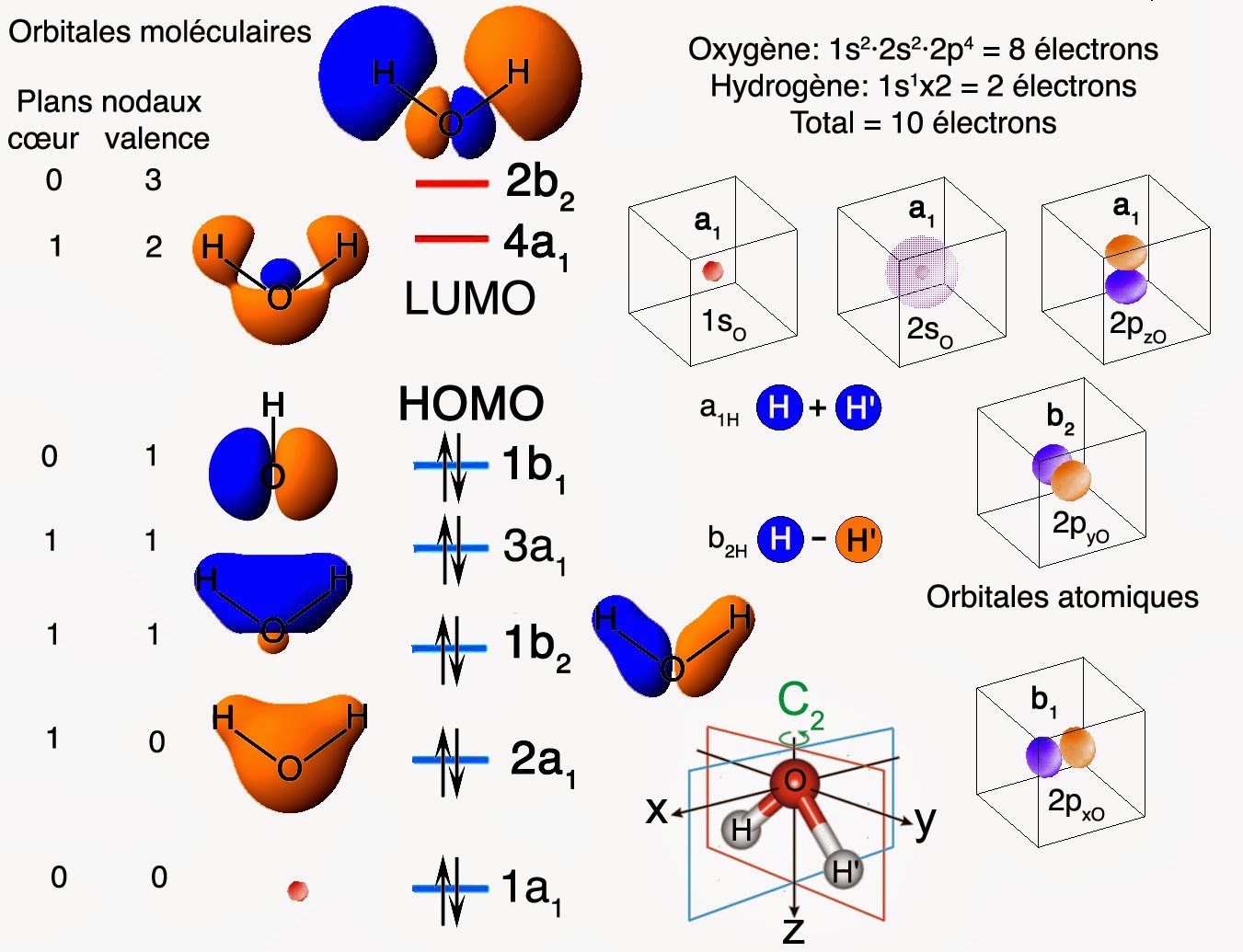
Il n’en reste pas moins que la forme qu’adoptera le nuage électronique global devra présenter les mêmes éléments de symétrie que celui associé à une structure en ‘V’. On appelle « orbitales moléculaires » ces formes caractéristiques des nuages électroniques qui décrivent les différents états de la molécule d’eau. Les voici représentées ci-dessous :
États totalement symétriques
Expliquons comment décoder un tel diagramme. On associe à chaque orbitale un niveau d’énergie bien défini. Deux électrons occupent un tel niveau, conformément au principe d’exclusion de Pauli. Les états électroniques de la molécule d’eau sont eux repérés au moyen d’un label unique. Ce label décrit comment se comporte le nuage électronique lorsque l’on applique les quatre opérations de symétrie qui laissent la molécule d’eau invariante.
Ainsi, le label a1 signifie que le nuage électronique reste identique à lui-même si l’on tourne la molécule de 180° autour de l’axe bissecteur de l’angle H-O-H. Une telle opération se note généralement par le symbole C2. Il y a aussi invariance si l’on prend l’image par réflexion dans un plan miroir bissecteur de l’angle H-O-H. Le symbole de symétrie devient ici σxz. Enfin, on peut aussi prendre l’image par réflexion dans un plan miroir correspond au plan qui contient la molécule. Ceci nous donne un dernier symbole de symétrie noté σyz. Ici aussi, une telle opération laisse invariante la forme globale du nuage électronique.
Autres états de symétrie
Le label b1 signifie quant à lui que les parties bleues et orange du nuage électronique s’intervertissent si l’on applique la rotation C2 ou l’opération miroir σyz. Par contre, le nuage électronique reste identique à lui-même si l’on applique l’opération miroir σxz. Enfin, le label b2 signifie pour sa part que les parties bleues et orange du nuage électronique s’intervertissent si l’on applique la rotation C2 ou l’opération miroir σxz. Mais, ici le nuage électronique reste identique à lui-même si l’on applique l’opération miroir σyz.
Configuration électronique
On peut résumer un tel diagramme au moyen de ce que l’on appelle une « configuration électronique ». Cette dernière décrit comment les 10 électrons de la molécule d’eau se répartissent parmi les différents niveaux disponibles :
\Gamma(H_{2}O) = \{ ( 1a_{1} )^{2}\}( 2a_{1} )^{2}( 1b_{2} )^{2}( 3a_{1} )^{2} ( 1b_{1} )^{2}\lbrack( 4a_{1} )^{0}( 2b_{2} )^{0}\rbrackTout ce qui se trouve entre accolades correspond à ce que l’on appelle les électrons de « cœur ». Seuls les rayons X sont capables d’arracher des électrons à ces niveaux de cœur. Tout ce qui se trouve entre crochets correspond à ce que l’on appelle les niveaux « anti-liants » ou niveaux « excités » ou bien encore niveaux « vides ». Pour placer la densité électronique dans de tels états, on doit, par exemple, utiliser une excitation optique. La molécule peut alors devenir très instable et parfois même exploser ou se dissocier.
HOMO et LUMO
Parmi ces niveaux vides, les chimistes singularisent le tout premier niveau vide sous le nom de « LUMO ». Car, c’est dans ce niveau que devront aller les électrons en provenance d’autres molécules lors de toute réaction chimique. Enfin tout ce qui se trouve entre le cœur et les niveaux vides correspond aux électrons de valence. Ce sont eux qui sont responsables de la couleur des choses ou bien des propriétés chimiques.
Les chimistes singularisent le dernier niveau occupé sous le nom de « HOMO ». C’est ce niveau d’énergie qui donnera ses électrons à toutes les autres molécules avides d’électrons lors de toute réaction chimique. La différence d’énergie entre ces deux niveaux HOMO et LUMO s’appelle le « gap HOMO-LUMO ». Il s’agit d’un bon indicateur de la stabilité de la molécule. Plus grand est ce gap, plus la molécule sera stable et non réactive. Plus le gap est faible, plus la molécule sera instable et hautement réactive.
On peut mesurer ce gap par la spectroscopie optique. Il se trouve être voisin de 7,4 eV ou 1186 zJ pour l’eau. Cette valeur est un gage de stabilité thermodynamique et chimique élevé pour une telle molécule.


Leave a Reply