L’eau intracellulaire
On me demande souvent la raison pour laquelle j’affirme qu’une cellule est composée à 99% d’eau. Et, non à 70% comme on le voit écrit dans de nombreux livres de biologie. Ou bien alors dans des articles consacrés à la composition chimique de la cellule. La question en corollaire est comment l’on peut arriver à un tel chiffre de 99%. Le problème est ici que les pourcentages sont des chiffres ambigus. Ils n’ont de signification que si l’on précise quelle unité a été employée pour exprimer calculer le pourcentage. Par exemple, lorsque l’on affirme que le vin possède un titre alcoolique de 13%, il est fondamental de savoir que l’on raisonne ici en volume. C’est-à-dire que dans 1 litre de vin, je trouve 130 mL d’alcool.
De même, que signifie l’affirmation qu’une cellule comme E. Coli contient 70% d’eau ? Il faut deviner ici que l’on raisonne maintenant en masse. C’est-à-dire que pour 100 g de bactéries E. Coli, il y a 70 g d’eau. Enfin, quand j’affirme que E. Coli est composée à 99% d’eau, je raisonne en moles. C’est-à-dire que pour 100 mol de bactéries E. Coli, il y a 99 moles d’eau.
Donc donner un pourcentage sans indiquer quel rapport d’unité on considère est une erreur majeure. Une telle erreur est généralement faite par des personnes qui n’ont pas été formés aux méthodes de la science. Un scientifique sait normalement toujours de quoi il parle. Mais, pour qu’il n’y ait pas d’ambiguïté, Il écrira que le vin contient 13 vol% d’alcool. Ou alors, qu’une bactérie E. Coli contient soit 70 pds% d’eau, soit 99 mol% d’eau. Ceci, afin que tout le monde sache de quoi l’on parle.
Analyse quantitative
Il faut également savoir quelle unité de quantité de matière est la mieux adaptée pour exprimer l’information que l’on souhaite transmettre. Ce point est discuté dans une autre page web de ce site. J’y précise l’intérêt des notions de volume, de masse et de mole. Pour ce qui est du calcul lui-même, il nécessite de connaître la masse de chaque molécule ou biopolymère. Mais, cela ne suffit pas. Il faut disposer de la masse molaire moyenne correspondante. Dans le cas d’E. Coli, le tableau suivant résume les données nécessaires pour faire les calculs nécessaires [1].
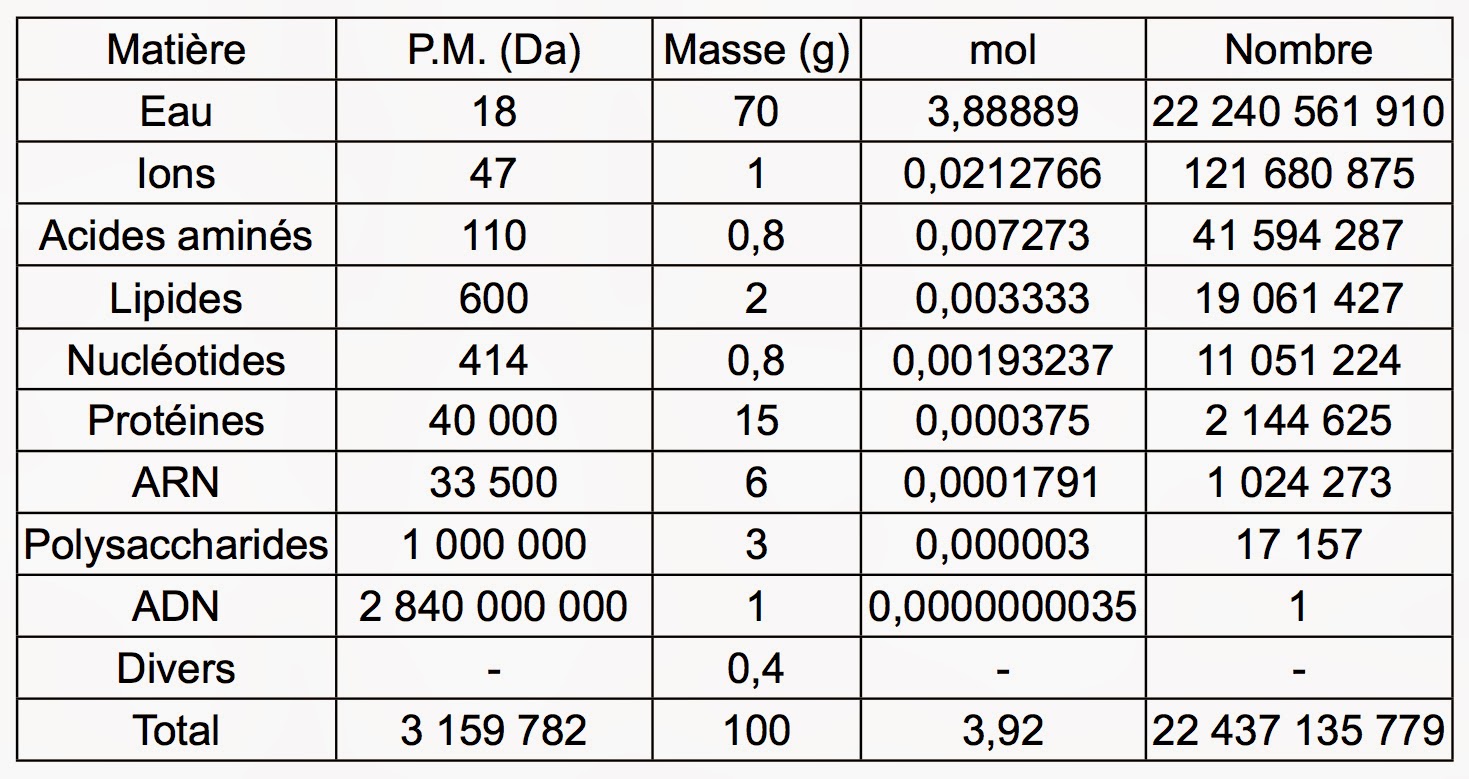
Pour trouver les valeurs en moles, j’ai utilisé la masse de 0,95 pg [2]. Les poids moléculaires (P. M.) de ce tableau sont évidemment des valeurs moyennes. Ceci, afin d’avoir un ordre de grandeur. Par exemple, que signifie la valeur de 47 Da pour les ions de la cellule ? Elle a été ici obtenue en considérant que les ions calcium, potassium, sodium, magnésium, chlorure, bicarbonate, phosphate et fer étaient présents en concentrations égales. Ce qui n’est bien sûr pas vrai. Une valeur plus précise aurait donc pu être obtenue en tenant compte des pourcentages relatifs de chaque ion. Mais, le résultat final de 3,92 moles n’aurait été que peu affecté. On notera aussi qu’en toute rigueur ces chiffres ne concernent qu’E. Coli. Il est toutefois clair qu’en termes de masse, toutes les cellules vivantes présentent des valeurs très similaires et que le calcul est donc général.
Importance de l’eau
Selon ce tableau, on a donc dans une cellule vivante typique 3,89 moles d’eau sur un total de 3,92 moles. D’où un pourcentage de 389/3,92 = 99,2 mol% que l’on peut arrondir par le bas à 99 mol%. Ceci, afin de tenir compte des erreurs liées à l’utilisation de poids moléculaires moyens. Mais, il y a aussi la variabilité cellulaire entre différents types de cellules. Maintenant, la vie est avant tout une affaire de mouvements et de chocs entre molécules de tailles nanométriques ou sub-nanométriques. Il est clair donc que la seule unité pertinente doit être la mole et non la masse. Par conséquent, pour la quantité d’eau contenue dans une cellule, il vaut mieux retenir le chiffre de 99 mol%. Et, oublier bien sûr celui de 70 pds% qui met plutôt en valeur l’inertie de la matière.
C’est ainsi que toute molécule qui évolue dans le milieu intracellulaire à 99 chances sur 100 de rencontrer lors de son mouvement de l’eau. D’où l’importance cruciale que joue cette molécule dans tous les processus cellulaires quels qu’ils soient. Ignorer ce fait fondamental ne peut donc que conduire à des erreurs d’interprétation des observations expérimentales. Il y a une autre information que l’on peut tirer de ce tableau.
C’est que le type d’espèces que l’on rencontre le plus fréquemment après l’eau sont avant tout les ions inorganiques. Viennent après les acides aminés, les lipides et les nucléotides. Il découle de ceci que la vie est avant tout une affaire de chimie des ions dans l’eau. Par conséquent, les grandes stars des livres de biologie (protéines, ARN, polysaccharides et ADN) sont loin de régner en maîtres sur le milieu intracellulaire. Ils se contentent plutôt d’être ballotés et chahutés par des hordes de petites molécules qui font réellement la loi.
Les ions de la cellule
Ceci ne veut bien sûr pas dire que ces biopolymères sont sans importance. Mais, simplement qu’il est extraordinairement dangereux et faux de croire qu’ils interagissent directement entre eux. Et, que les petites molécules se contentant de boucher les trous générés par ces énormes mastodontes. Tout biopolymère interagit donc avec un autre exclusivement via ses couches d’eau adsorbées. Et, aussi via ses doubles couches électriques. A aucun moment, il n’y a d’interaction directe. Comme ce n’est pas vraiment ce qui est souligné dans les livres de biologie, j’ai pris le soin de clarifier ce point.
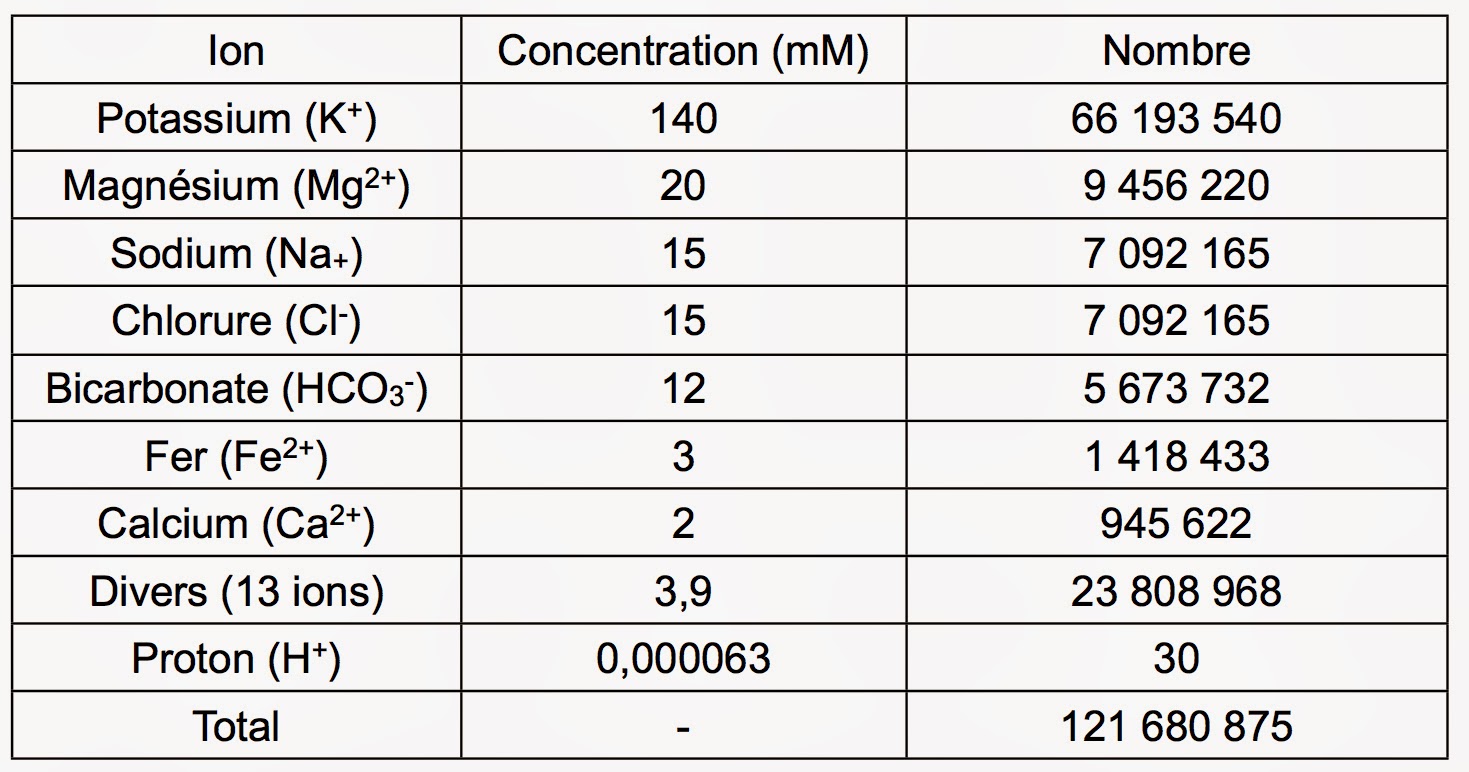
Pour ce qui concerne les ions, on peut raisonner en volume. On sait qu’une bactérie E. Coli a la forme d’un bâtonnet possédant un rayon de 0,5 µm pour une longueur de 1 µm. Le volume d’une telle cellule est donc de 785,4 femtolitres. D’où un volume millimolaire de 472 811 L·mmol-1. Le tableau suivant donne la concentration millimolaire en milieu intracellulaire des principaux ions de la cellule (20 au total) [3] :
Rôle des minéraux
On voit ainsi que le potassium joue un rôle crucial pour la vie de la cellule. Perdre son potassium signifie donc la mort. On trouve ensuite un groupe de 4 ions d’où se détache le magnésium. De fait, il s’agit du contre-cation de tous les nucléotides avec une concentration de seulement 0,5 mM dans le cytosol. On trouve ensuite le chlorure de sodium. C’est ici le sel qui gouverne les entrées et les sorties d’eau dans la cellule. Enfin, il y a les ions bicarbonates qui contrôle l’acidité du milieu intracellulaire. Dans le dernier groupe, on trouve le fer, autorisant la cellule à faire des réactions d’oxydo-réduction. Puis, l’ion calcium, messager universel contenu essentiellement dans des vésicules. Car, sa concentration dans le cytosol n’est que de 0,1 µM.
Cependant, on trouve aussi du calcium dans le milieu intracellulaire de certaines cellules spécialisées. Car, contrairement au magnésium, le calcium forme des complexes extrêmement stables et insolubles avec les ions phosphates. C’est ainsi que se forme apatite que l’on retrouve dans les os ou dans les dents. Par contre, la libération massive des ions calcium contenus dans les vésicules dans le cytosol est le mécanisme par lequel une cellule se suicide. Cela s’appelle l’apoptose. En effet, une fois libéré, le calcium va chasser le magnésium associé aux nucléotides. Ceci prive évidemment la cellule de son ATP permettant de solubiliser les protéines. Car, ce dernier contient trois groupements phosphate extrêmement vulnérables à l’attaque par le calcium.
On notera enfin qu’il n’existe qu’une trentaine de protons libres dans une cellule. Ceci signifie que la notion de pH n’a évidemment aucun sens pour un nombre d’espèces aussi bas. Pour ce qui concerne les ions regroupés sous l’appellation “divers”, on pourra se référer à la page consacrée à l’absorption des minéraux.
Références
[1] J.D. Watson, “Molecular Biology of the Gene”, 2nd ed., Philadelphia, PA: Saunders, (1972).
[2] F. C. Neidhardt, “Escherichia coli and Salmonella: Cellular and Molecular Biology”. Vol 1. pp. 14, ASM Press (1996).
[3] Alberts B, Johnson A, Lewis J, et al., “Molecular Biology of the Cell”, 4th edition, New York: Garland Science; (2002).


Leave a Reply