Épisode 13, Covid-19, mai 2020
Dans la dernière chronique je vous ai parlé du tribunal NLRP3. Ce tribunal se mobilise dès qu’un Mr Loyal se retrouve dénudé en partie ou en totalité sur la piste de cirque. Le même phénomène se produit dès qu’un Mr. Loyal se trouve amputé d’un morceau de son corps. Bref, tout ce qui, dans le cytoplasme, ressemble de près ou de loin à un fragment d’acide nucléique mobilise la police et la justice.
Le tribunal AIM2
En matière d’infection, le SARS-CoV-2 peut très bien provoquer la réunion d’un autre tribunal appelé AIM2. Cet acronyme signifie : protéine du deuxième type actionnable par l’interféron. Or, tout agent pathogène possède des motifs moléculaires appelés PAMPs dans le jargon biologique. Ces motifs peuvent initier la réunion du tribunal AIM2. Ce dernier a un double rôle. D’une part, le tribunal doit « sentir » les PAMPS des agents pathogènes. D’autre part, il se doit d’être le garant de l’intégrité cellulaire.
Comme tout tribunal cellulaire, cette protéine possède côté amine un repliement mortel de type pyrine. On retrouve ici le PYD de la chronique n°12. Ce repliement permet l’auto-assemblage du tribunal. Du côté carboxylate, on trouve un domaine HIN-200. Cet acronyme signifie : protéine nucléaire hématopoïétique à 200 acides aminés actionnable par l’interféron. Ainsi, Il s’agit d’une protéine capable de se lier à tout fragment d’ADN double brin détecté dans le cytosol. Deux racines grecque, haímatos (« sang ») et poíêsis (« création »), forment le terme hématopoïétique. Il signifie que ces protéines interviennent lors de la production de cellules sanguines au niveau de la moelle osseuse rouge.
Elles apparaissent en présence d’une autre protéine appelée interféron. Elle, cherche à interférer avec le développement des virus. Par fixation d’interféron, HIN-200 active à son tour, par un baiser moléculaire, une belle au bois dormant. Cette belle répond au doux nom de NF-κB. Cet acronyme signifie : facteur (F) nucléaire (N) stimulé par la chaîne légère de type kappa (κ) d’immunoglobulines appartenant aux lymphocytes B activés. Si cela vous donne le tournis, allez relire la chronique n°11 à la section lymphocyte B et anticorps.
Immunoglobulines
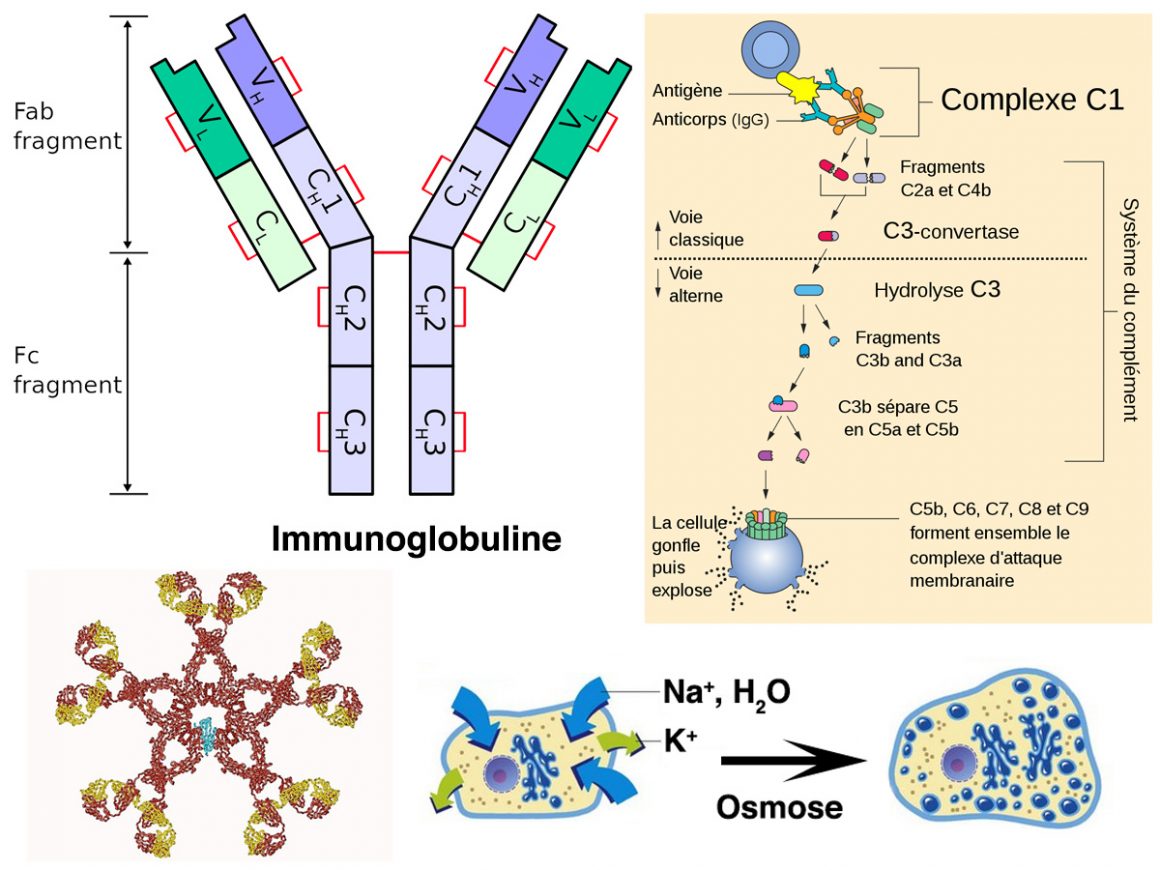
Le terme immunoglobuline fait référence à la quatrième fraction de protéines sériques. Ce sont les globulines gamma. Ces protéines migrent dès qu’on applique un champ électrique au sérum sanguin. C’est le phénomène d’électrophorèse capillaire. La première fraction migrante est l’albumine. La deuxième fraction sont les globulines dites alpha. Une troisième fraction forme les globulines dites bêta. Quant au préfixe immuno, il signifie que ces protéines appartiennent au système immunitaire, c’est-à-dire à la police de la cellule. Pour les intimes, les immunoglobulines se notent Ig. C’est le mot savant pour dire anticorps.
Sur un plan moléculaire, un anticorps est une glycoprotéine constituée de deux doubles chaînes. Environ 450 acides aminés constituent un premier type de chaîne dit « lourd ». Son symbole est la lettre ‘H’, première lettre du mot anglais heavy. Il y a cinq parfums différents : IgM, IgG, IgA, IgD et IgE. D’autre part, 212 acides aminés définissent un deuxième type de chaîne dite « légère ». Son symbole est la lettre ‘L’, première lettre du mot anglais light. Cela correspond à deux parfums : kappa ou lambda.
Structure
Les bouts aminés des chaines L ou H forment des boucles de composition très variable. D’où deux premiers labels (VL et VH). Via un pont disulfure VL-S-S-VH très flexible on forme ainsi la partie « serrure » de l’anticorps. On appelle paratope cette partie flexible. Elle peut accueillir de manière très spécifique la partie « clé » d’un antigène dite épitope. Le symbole Fab dénote pour sa part le fragment « serrure ». Il s’agit d’un nouvel acronyme signifiant : fragment de liaison à l’antigène. Codées sur les domaines VH et VL de l’anticorps, on trouve 3 régions complémentaires déterminantes (acronyme CDR). Ces régions contiennent entre 5 et 10 acides aminés. 4 parties relativement constantes, dite charpentes, encadrent ces domaines.
Les bouts carboxylates des immunoglobulines ont pour leur part une composition constante. On indique cela via deux autres labels (CL et CH). Il y a un seul domaine CL pour trois domaines CH. Une liaison existe entre les deux domaines CH1 et VH. Le domaine CL assure le lien entre une chaîne H et sa chaîne L associée. Le domaine CH2 établit des ponts disulfures entre deux chaînes H via une région charnière. C’est ce domaine qui porte les chaînes polysaccharides. Enfin, le domaine CH3 joue le rôle de récepteur pour la membrane d’un lymphocyte B. La partie CH2-CH3 de la « serrure » VL-S-S-VH est aisément cristallisable. Elle forme un fragment dit ‘Fc’. La coupure se fait au moyen d’une enzyme végétale, la papaïne.
Fonctions
C’est ce dernier fragment Fc qui est porteur des fonctions effectrices des anticorps. Ces fonctions permettent d’une part d’activer la cascade du complément après liaison de l’anticorps à son antigène. D’autre part elles assurent la liaison à des récepteurs spécifiques. Tout polynucléaire neutrophile (PN) qui se respecte porte de tels récepteurs. De même pour les macrophages lorsqu’il s’agit de phagocyter le condamné à port recouvert d’IgG. On parle alors d’opsonisation. Les récepteurs peuvent aussi appartenir à des lymphocytes. Il s’agit alors simplement de tuer le condamné sans le phagocyter pour autant.
Les protéines du complément
La cascade du complément est une partie du système immunitaire inné. C’est celle qui amplifie (complémente) la capacité des anticorps et des phagocytes à éliminer tout ce qui a été condamné à mort dans une cellule. Ce complément reste le même tout au long de la vie d’un individu. Son recrutement est néanmoins possible via par les anticorps du système immunitaire adaptatif. Il s’agit d’un ensemble de 30 protéines. Ces protéines migrent sous l’action d’un champ électrique avec la fraction des globulines bêta. La lettre ‘C’, pour complément, suivie d’un numéro allant de 1 à 9, identifie les protéines principales.
C’est le foie qui synthétise, sous une forme inactive, les protéines du complément. Ces dernières circulent dans le sang, mais elles peuvent aussi s’associer aux membranes cellulaires. Ces protéines sont de véritables ciseaux et fonctionnent comme des protéases. Elles peuvent couper d’autres protéines. Ce faisant, elles génèrent des cytokines. Ainsi qu’une cascade de nouveaux clivages. Il s’agit en fait d’une réaction en chaîne. Comme celle que l’on l’observe lors d’une explosion chimique mettant en jeu des espèces radicalaires. Ou bien alors d’une explosion nucléaire mettant en jeu des neutrons. Dans le cas présent, les cytokines et des protéases remplacent les radicaux ou les neutrons.
La cascade du complément
Il existe deux voies principales d’activation du complément. La voie classique et la voie alterne. Dans les deux cas, la protéine C3 joue un rôle pivot. La voie classique s’initie dès que deux fragments FC de deux complexes de type antigène-anticorps IgM se retrouvent à proximité l’un de l’autre. Cela se produit à la surface d’un condamné à mort. Le même phénomène se produit dans une moindre mesure avec le type IgG. Ce rapprochement des régions Fc attire la partie C1q du mastodonte C1. Ce faisant, la partie C1r clive la troisième partie C1s dudit mastodonte. Après cette première étape d’activation, il y a libération du fragment C1s. Une fois libéré, ce dernier n’a qu’une idée en tête. Venir cliver la protéine C4 en deux morceaux.
On forme ainsi le morceau C4a qui part dans le sang. L’autre morceau C4b vient se fixer sur la membrane du condamné à mort. Une fois ancré sur la membrane le fragment C4b recrute l’agent C2. Le but est de le cliver à son tour, si cela n’a pas déjà été fait par le redoutable ciseau C1s. Tandis que le fragment C2b part dans le sang, le duplex restant C4bC2a devient la C3-convertase. Son obsession est de scinder l’agent C3 en C3a qui part dans le sang. L’autre morceau C3b forme la triplette C4bC2aC3b appelée C5-convertase. Chacun de ces clivages libère donc dans le sang des petits fragments : C4a, C2b et C3a. Ces fragments vont amplifier la réponse inflammatoire. Ils le font en stimulant la migration des leucocytes vers le site de l’infection. Voilà pourquoi on parle de cascade.
Sabotage et noyade
Toutefois, notre histoire ne s’arrête pas là. Il est en effet temps, pour une équipe de saboteurs, de se réunir à la surface du condamné à mort. Le but du commando est d’ouvrir un ou plusieurs canaux dans la membrane lipidique du condamné pour lui crever le bide. Ainsi, aussitôt fixé de manière covalente sur la membrane, la triplette C5-convertase va s’empresser de cliver l’agent C5. Le morceau C5a part bien sûr dans le sang. L’autre morceau C5b attire quant à lui le saboteur C6. L’idée est de former le duplex C5b-C6 dont les atours attire irrésistiblement le saboteur C7. On forme ainsi la triplette C5b-C6-C7. Un site lipophile particulièrement obscène se trouve ainsi exposé.
Vu son obscénité, ce site se retrouve donc immédiatement enfoui dans la membrane du condamné. Ceci attire le site lipophile d’un saboteur C8 toujours à l’affût pour former la quadrette C5b-C6-C7-C8. Aussitôt formée, c’est la grande partouze. En effet, 10 à 16 exemplaires du saboteur C9 viennent créer un canal appelé MAC. Cet acronyme signifie complexe d’attaque membranaire. Une face externe lipophile traversant la membrane de part en part et d’une face interne hydrophile caractérise ce complexe MAC. Le canal ainsi formé provoque alors un afflux d’eau par osmose. Résultat, la cellule condamnée éclate comme un ballon de baudruche.
Nettoyage
Bien évidemment après ce massacre il y aura plein de débris partout. Ceci nécessite de stimuler la phagocytose. Il faut, de fait, nettoyer non seulement les cadavres des intrus, mais aussi ceux des victimes. Tout ce qui porte l’étiquette ‘Ig’ à sa surface membranaire doit mourir, sans appel possible, par noyade. Cette noyade s’accompagne d’un véritable brasier inflammatoire tout autour du lieu de mise à mort. On appelle « anaphylatoxines » les fragments C3a et C5a. Leur rôle est de libérer l’histamine, médiateur de la réponse allergique. Toute personne ayant eu des allergies peut comprendre avec quelle rapidité l’incendie peut se propager.
Voie alterne
La voie alterne d’activation du complément ne passe pas par le couple antigène-anticorps. Ce sont les lipopolysaccharides présents à la surface des bactéries qui initient cette voie. De manière plus générale, par toute surface pauvre en acides sialiques. Or, ces molécules sont relativement rares dans les membranes de certains virus. Il en est de même pour les membranes des levures, des parasites ou des cellules tumorales. Des substances chimiques peuvent activer la voie alterne. C’est le cas du gluten, des fibres d’amiante et de certains produits iodés. Ici c’est la coupure spontanée de l’agent C3 en C3a et C3b qui est à l’origine de la cascade.
Lorsque la coupure se produit dans l’eau, tout se passe bien, car le fragment C3b se trouve inactivé. Toutefois, si jamais la coupure se produit au voisinage des entités précitées, C3b va aussitôt cliver un facteur B en deux fragments Ba et Bb. L’idée est de former une C3-convertase alterne C3bBb. Ce duplex va alors cliver un autre agent C3 pour former la tête de pont C3bBbC3b. Cette triplette agit alors comme une C5-convertase alterne. Elle va de fait cliver l’agent C5. Ceci aboutit, comme vu plus haut, à la lyse de toute cellule suspecte d’avoir côtoyé à un moment donné de son existence des individus biologiques ou des substances chimiques bien peu fréquentables.
Choc septique
Toute détection d’un PAMPS viral entraîne la réunion du tribunal AIM2. Ce dernier décrète alors le départ de l’inhibiteur IκB collé à la belle endormie NF-κB. Aussitôt séparée de son geôlier, cette dernière se précipite vers le noyau afin d’y transcrire les gènes associés à la réponse immunitaire. Il peut y avoir ainsi création de lymphocytes B ou apoptose. Hélas aussi, carcinogenèse ou inflammation violente. On initie ainsi une cascade très dangereuse.
Cette cascade peut soit aboutir à sortir vainqueur de l’infection virale, soit au contraire provoquer un choc septique. Ce choc pourra faire passer le malade de vie à trépas. Ce, juste après avoir vaincu le virus SARS-CoV-2. Car le corps n’a pas forcément les moyens d’éteindre l’incendie allumé pour se défendre. Mourir en étant guéri du virus. C’est l’un des aspects les plus déroutants de cette maladie COVID-19.
Par Marc HENRY


Leave a Reply