Dater une météorite
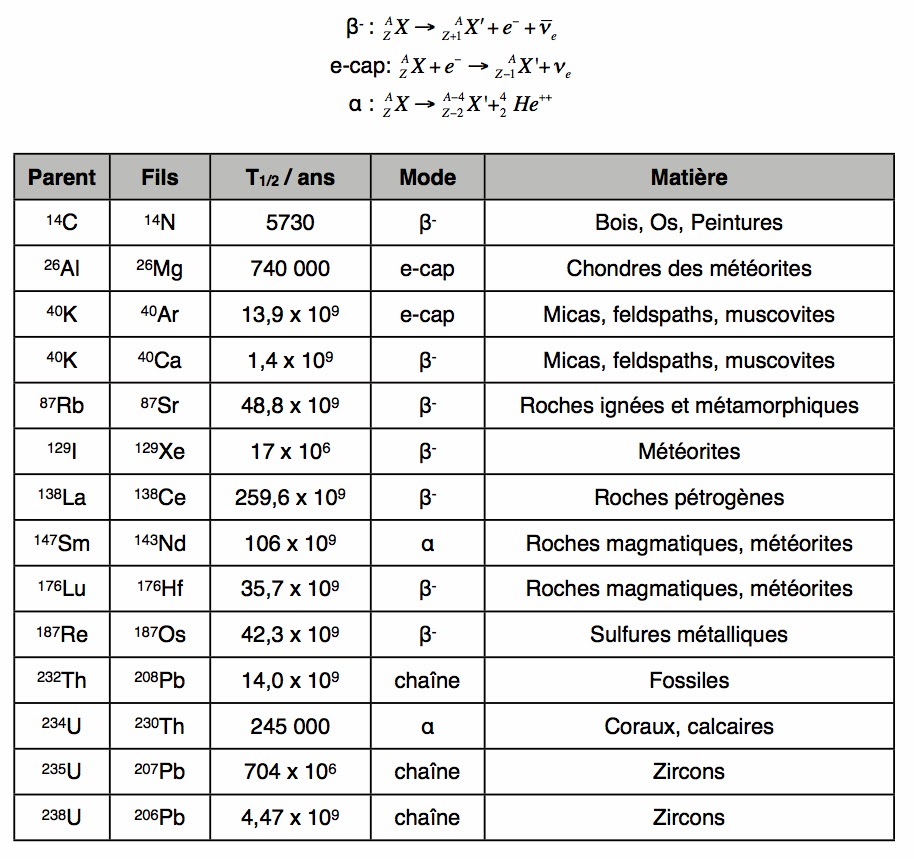
La figure ci-dessus donne une liste des isotopes qui peuvent être utilisés à des fins de géochronologie. Voyons à titre d’exemple comment l’on procède pour dater une météorite. La désintégration du 87Rb en 87Sr se caractérise par une demi-vie de 49 milliards d’années. Celle du 146Sm en 142Nd a une demi-vie de 106 milliards d’années. Ces isotopes font donc parfaitement l’affaire, puisque l’âge de l’univers ne dépasse pas 15 milliards d’années. Prenons l’exemple d’une datation au moyen de l’isotope 87Rb.
Si une météorite contient une certaine quantité de cet isotope radioactif, on trouvera nécessairement son produit de désintégration 87Sr. Ce, en plus de la quantité initiale de cet isotope, a priori inconnue, présent au moment de la formation de la météorite. Soit donc 87Sr(t) la quantité d’isotope 87Sr mesurée à un instant t. Elle doit être égale à la quantité initiale 87Sr(0) additionnée de celle provenant de la désintégration de l’isotope 87Rb :
87Sr(t) = 87Sr(0) + [87Rb(0) – 87Rb(t)]
Décroissance radioactive
Or, on sait que la concentration en isotope 87Rb décroît selon une loi exponentielle. Cette décroissance se caractérise par un certain taux de désintégration par unité de temps λ : 87Rb(0) = 87Rb(t)·exp(λ·t). Ceci permet donc d’écrire que :
87Sr(t) = 87Sr(0) + 87Rb(t)[exp(λ·t) – 1].
Or, il existe un autre isotope parfaitement stable du strontium, 86Sr, dont la concentration ne varie pas au cours du temps. Ceci conduit donc à la relation :
87Sr(t)/86Sr = 87Sr(0)/86Sr + (87Rb(t)/86Sr)·[exp(λ·t) – 1].
Il suffit donc de représenter la variation du rapport 87Sr(t)/86Sr en fonction du rapport 87Rb(t)/86Sr. On doit ainsi obtenir une droite de pente [exp(λ·t) – 1] correspondant à l’âge de la météorite. Le point où la droite coupe l’axe des ordonnées correspond au rapport initial 87Sr(0)/86Sr au moment de la formation de la météorite.
Spectrométrie de masse
Ces rapports sont généralement mesurés par spectrométrie de masse. On vaporise ainsi une petite quantité de la météorite dans une chambre d’ionisation. Les ions formés sont ensuite accélérés par un champ électrique. Après collimation, les ions passent à travers un système de fentes pour entrer dans une région où l’on applique un champ magnétique. Selon les lois de l’électromagnétisme, ce champ magnétique va imposer une trajectoire en forme de cercle au faisceau d’ions. On montre alors que le rayon du cercle est fonction du rapport charge/masse.
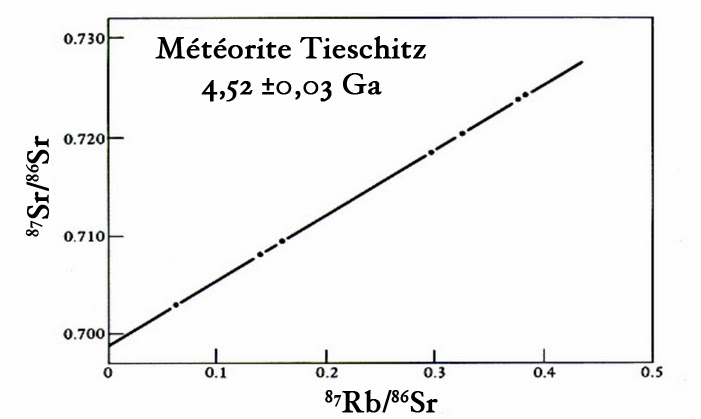
On est ainsi capable de trier les isotopes suivant leurs masses respectives. Ceci permet alors de mesurer leurs rapports d’abondance de manière très précise. On réalise ce type de mesures sur plusieurs échantillons de la même météorite qui ont été prélevés à des endroits différents. On obtient ainsi une droite dite « isochrone » dont la pente permet de dater la météorite. Voici par exemple l’isochrone obtenue pour la météorite Tieschitz tombée en 1878 en Tchécoslovaquie. On a pu ainsi avancer un âge de 4,52 milliards d’années pour cette roche :
L’isotope 14C
Un isotope est considéré comme éteint au bout d’une durée de 6 demi-vies. Certains isotopes, comme le 14C, qui sont éteints par rapport à l’âge de la Terre peuvent néanmoins être régénérés par les rayons cosmiques. Ainsi si l’azote atmosphérique interagit avec un rayon cosmique, il peut se transmuter de la manière suivante : n° + 14N → 14C + p+. Cet isotope radioactif du carbone est alors incorporé à la molécule de dioxyde de carbone CO2. Ceci permet au 14C d’entrer dans la chaîne alimentaire via le processus de photosynthèse.
Tant qu’un organisme reste vivant il régénère en permanence son taux de 14C qui reste donc constant. En revanche, dès qu’il meurt, ce taux diminue régulièrement au cours du temps selon la loi de décroissance radioactive. Ce phénomène constitue la base de la technique de datation au 14C.
Datation du corail
Les êtres vivants comme les coraux se nourrissent à partir d’eau et non d’air. Toutefois, ils sont capables d’assimiler l’uranium de l’eau de mer sous la forme de carbonates, mais pas le thorium qui est insoluble. Lors de leur mort, cette assimilation s’arrête. Comme l’uranium n’est plus régénéré, il se désintègre naturellement en 230Th . Par conséquent, la concentration de cet isotope augmente régulièrement au cours de temps. C’est ce qui autorise la datation du corail. À titre d’information, voici la chaîne de désintégration radioactive de l’isotope 238U :
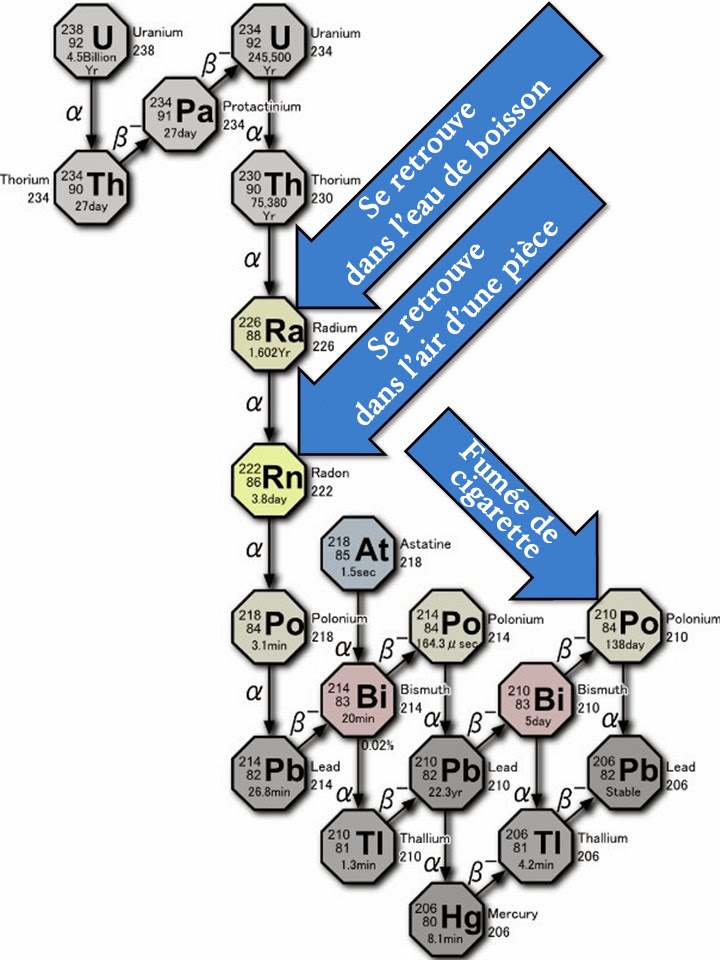
Ce diagramme souligne les produits de désintégration posant problème soit pour l’eau que l’on boit soit pour l’air que l’on respire. Pour le problème posé par la fumée de cigarette suivre ce lien.


Leave a Reply