Règle stricte de l’octet
On cherche ici à écrire une Structure de Lewis obéissant à la règle stricte de l’octet pour la taurine. Il s’agit d’une molécule acyclique de formule brute C2H7NO3S. La molécule étant non cyclique on a c = 0. Il faut ensuite évaluer le nombre d’électrons de valence. Chaque atome d’hydrogène apportant 1 électron de valence, le carbone 4, l’azote 5 et l’oxygène ou le soufre 6, il vient :
V = (2×4 + 7 + 5 + 3×6 + 6)/2 = 44/2 = 22
Il y a donc un total de 24 paires d’électrons dans cette moélcule. Comme il y a h = 7 atomes d’hydrogène et q = 2 + 1 + 3 + 1 = 7 atomes lourds, le nombre de liaisons simples vaut:
σ = h + q + (c – 1) = 7 + 7 + 0 – 1 = 13
Cette molécule ne peut pas avoir de liaisons multiples car:
V + c = 3q + 1 – π ⇒ 22 + 0 = 3×7 + 1 – π ⇒ π = 0
Enfin il doit y a avoir 9 paires non partagées puisque λ = V – σ – π = 22 – 13 – 0 = 9. Voici donc la solution:
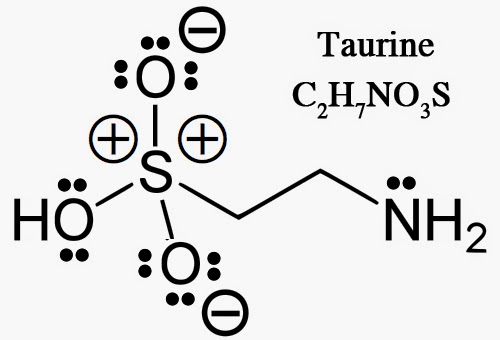
Charges formelles pour O, N et S
On remarquera la présence de charges formelles sur 2 des atomes d’oxygène et sur l’atome de soufre. On les évalue de la manière suivante. Pour l’atome d’oxygène du groupement hydroxyle OH, on compte 1 électron partagé entre l’oxygène et le soufre. On compte aussi 1 électron entre l’oxygène et l’hydrogène. Enfin, il y a 2 paires d’électrons non partagées, soit :
φ(O) = 6 – 2×2 – 1 – 1 = 0
Pour l’atome d’azote du groupement amine NH2, on compte 1 électron partagé entre l’azote et le carbone. De même, il y a 1 électron entre l’azote et l’hydrogène. Enfin, il y a 1 seule paire d’électrons non partagés, soit :
φ(N) = 5 – 2×1 – 1 – 2 = 0
Atomes d’oxygène du groupement sulfonate non protonés: On compte 1 électron partagé entre l’oxygène et le soufre et 3 paires non partagées, soit:
φ(O) = 6 – 3×2 – 1 = -1
Pour l’atome de soufre, on compte 1 électron pour chacune des 4 liaisons simples, soit :
φ(O) = 6 – 4×1 = +2
Charges formelles pour C et H
Comme souvent en chimie, les atomes de carbone ne sont pas explicitement représentés. Toutefois, ils sont toujours présents dès qu’au moins 2 liens se rencontrent en un endroit du diagramme appelé nœud. Les atomes d’hydrogène portés par ces atomes de carbone “invisibles” sont, eux aussi, généralement omis. Mais, leur nombre est égal à 4 moins le nombre de liens qui se rencontrent en un même nœud. Ici, il y a bien 2 nœuds bi-connectés qui portent donc chacun 4 – 2 = 2 atomes d’hydrogène. La charge formelle de ces deux atomes de carbone implicites vaut donc :
φ(C) = 4 – 4×1 = 0
Enfin les atomes d”hydrogène ont également une charge formelle nulle car ils ne peuvent former qu’une seule liaison apportant 1 électron, soit:
φ(H) = 1 – 1 = 0
Remarques
On remarquera que malgré la présence de ces charges, la molécule est dans son ensemble électriquement neutre : 2×0 + 7×0 + 0 + 0 -2×1 + 2 = 0. Il faut bien faire attention de ne pas confondre ces charges formelles avec les nombres d’oxydation qui sont une autre manière de compter les électrons. De même, il s’agit d’une notion bien distincte des charges partielles qui décrivent la polarité réelle des liaisons. Il peut être aussi instructif de comparer notre écriture à celle donnée par Wikipédia.
Pour une raison étrange, Wikipédia préfère faire apparaître deux doubles liaisons soufre-oxygène complètement fictives. Il s’agit ici de faire disparaître les charges formelles. Wikipédia oublie aussi d’indiquer les doublets non partagés. C’est la multiplication de ce genre d’oublis, certains anodins, d’autres très graves qui rend la chimie et par voie de conséquence la biologie très énigmatique. Utiliser les formules chimiques données par Wikipédia, c’est se contenter d’une connaissance très superficielle. Généralement, on renonce à une compréhension profonde des choses.
Intérêt des charges formelles
Pour comprendre cela, regardez à nouveau notre formule de la taurine. Si je cherche à réduire cette molécule en lui apportant des électrons, où vont-ils aller ? Les électrons étant négativement chargés, ils auront tendance à aller sur le soufre qui porte une forte charge formelle nettement positive. Si au contraire, je cherche à oxyder la molécule, où vais-je chercher les électrons ? Évidemment sur les atomes qui portent une charge formelle négative…
Faites disparaître les charges comme le fait systématiquement Wikipédia et essayez de répondre aux mêmes questions. Là, c’est beaucoup moins évident et il faut faire appel à sa mémoire pour arriver à des conclusions chimiquement correctes. C’est ce souci de rigueur dans l’écriture des formules chimiques qui simplifie la compréhension des phénomènes chimiques et biologiques. C’est d’ailleurs ce qui fait l’originalité de ce site par rapport aux autres traitant du même sujet. À vous de choisir…


Leave a Reply