Poids atomiques
L’acceptation de la notion d’atome tout au long du dix-neuvième siècle a été laborieuse. Ceci en raison de la précision des mesures de poids atomiques. Entre 1798 et 1804, le chimiste français Joseph Proust énonce la loi des proportions définies. Ainsi, il considère l’union de deux corps simples ou composés pour former un composé défini. Il remarque alors que leur combinaison s’effectue toujours selon un même rapport pondéral. Par exemple, quelle que soit la masse d’eau considérée, le rapport entre la masse d’hydrogène et la masse d’oxygène entrant dans la composition de l’eau est toujours de 1/8. Cette loi affirme donc l’invariabilité des proportions massiques des éléments combinés au sein d’une espèce chimique donnée.
Pour justifier cette loi, le chimiste anglais William Prout avança l’hypothèse que tous les éléments étaient composés d’hydrogène. Car, cet élément présente le poids atomique le plus faible. Une des conséquences de cette hypothèse était que tous les poids atomiques devaient être aux erreurs expérimentales près proches de nombres entiers. Cette hypothèse fut malheureusement rejetée dès 1820. Particulièrement par le chimiste suédois Jöns Jacob Berzelius. En effet, ce dernier montra clairement que la masse atomique du chlore était de 35,45. Donc, une valeur complètement incompatible avec l’hypothèse de Prout. De fait, compte tenu de la précision des balances, il était hors de question que l’écart de 0,5 par rapport aux valeurs entières de 35 et de 36 soit une erreur de mesure.
Radioactivité
En 1844, le chimiste français Charles Marignac proposa ainsi d’attribuer à l’hydrogène une masse demi-entière. Ceci afin de faire rentrer le chlore dans le rang avec un poids atomique de 71. Le problème, c’est qu’il fallait aussi faire rentrer dans le rang les autres éléments récalcitrants. Par conséquent, il fallut prendre en 1858 comme unité de base le quart de 1 gramme. Ceci était assez gênant pour des atomes réputés insécables et incassables. On comprendra donc aisément la raison pour laquelle beaucoup de chimistes de l’époque considéraient l’hypothèse de Prout comme une pure illusion. Ils préféraient de loin la théorie des équivalents où la notion d’atome n’avait pas droit de cité. La solution à ce problème allait venir de la découverte du phénomène de radioactivité. Car, cela allait permettre de mieux comprendre la structure des atomes.
Ce sont les chimistes français Pierre et Marie Curie qui identifièrent et isolèrent les éléments radioactifs. C’est-à-dire ceux responsables de l’émission de rayons énergétiques. Cela se produit avec l’uranium, le polonium et le radium. On disposait donc de sources radioactives nombreuses et variées. Rutherford montra ainsi que ces rayonnements étaient de trois natures différentes : alpha, bêta et gamma. Grâce à ces rayons, il était possible de réaliser le vieux rêve alchimique de transmutation des éléments. En étudiant les rayons alpha, Rutherford va ainsi découvrir que la charge d’un atome Z est sensiblement égale à la moitié de son poids atomique A : Z ≈ A/2. Ceci donna naissance au concept de numéro atomique Z.
Système périodique des éléments
Or, il y avait aussi un physicien amateur hollandais Antonius Johannes van den Broek (1870-1926). Ce dernier cherchait à donner une base physique claire au système périodique des éléments développé dès 1869 par le chimiste et mathématicien russe Dimitri Ivanovich Mendeleev (1834-1907). L’hypothèse de van den Broek fut confirmée expérimentalement en 1914 par le jeune physicien anglais Henry Moseley. Celui-ci montra que lorsqu’on bombardait des atomes avec des électrons, il y avait émission de rayons X. Les fréquences de ces rayons X étaient directement proportionnelles au carré d’un nombre entier. Nombre qui représentait la position de l’élément dans la classification périodique de Mendeleev.
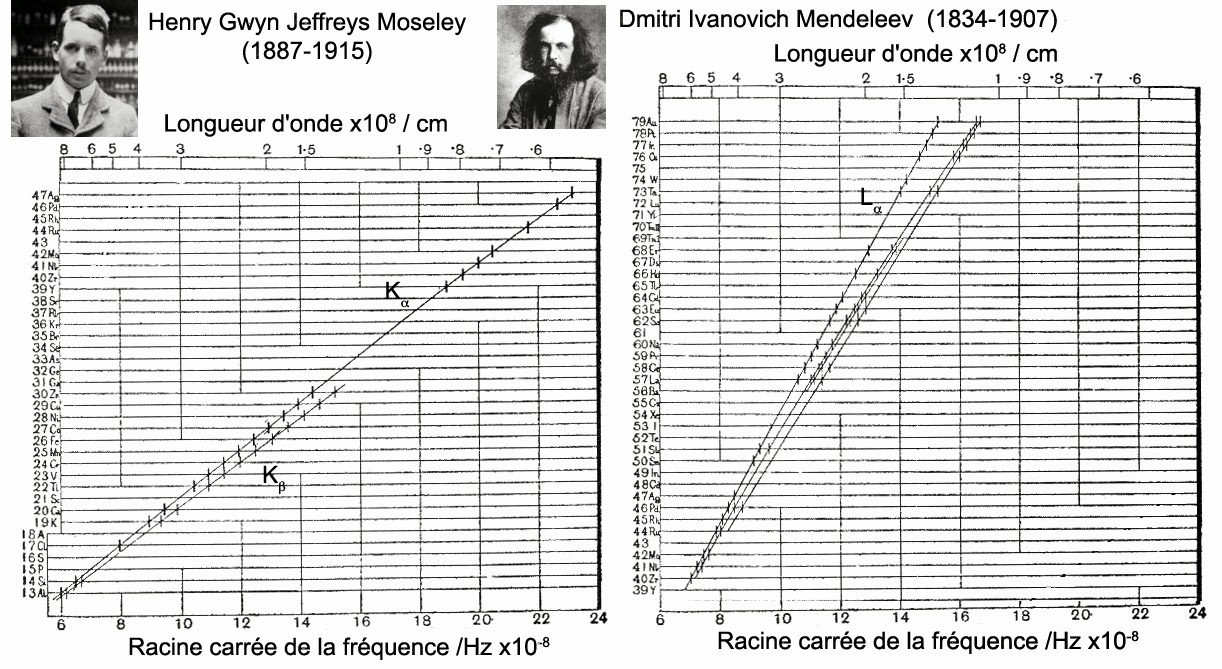
Cette loi validait complètement la théorie atomique du physicien danois Niels Bohr. Elle montrait qu’il ne restait à découvrir dans la classification de Mendeleev que 4 éléments entre l’aluminium (Z=13) et l’or (Z=79). Il s’agissait des numéros atomiques 43 (Tc), 61 (Pm), 72 (Hf) et 75 (Re). Bien évidemment, tout ceci remettait au goût du jour la vieille hypothèse de Prout. Celle qui prétendait que tous les éléments étaient composés d’hydrogène, premier élément de la classification (Z = 1). Toutefois, avec le phénomène de radioactivité une pléthore de nouveaux éléments apparaissaient chaque jour. La classification périodique fut donc bientôt beaucoup trop petite pour les contenir tous. Cependant, grâce à la loi de Moseley, les chimistes suédois Daniel Strömholm (1871-1961) et Theodor Svedberg (1884-1971) remarquèrent que certains éléments ayant des masses différentes avaient étrangement le même numéro atomique.
Le proton
C’est ainsi que le chimiste britannique Frederick Soddy (1877-1956) forgea, en 1913, le terme « isotope ». Ce mot dérive du grec iso (identique) et topos (lieu). Via cette notion d’isotopes le poids atomique non entier du chlore devenait aisément explicable. Il s’agissait, tout simplement, d’une moyenne pondérée (3/4 et 1/4) entre deux isotopes principaux de poids 35 et 37. Dès 1917 Rutherford était capable de produire des noyaux atomiques d’hydrogène en envoyant des particules alpha sur du gaz hydrogène. Il constata alors que ces mêmes particules traversant l’air et même l’azote pur faisait également apparaître ces noyaux d’hydrogène en transformant l’azote-14 en oxygène-17 selon la réaction : 14N + α → 17O + p.
Influencé par l’hypothèse de Prout, il fit une supposition. À savoir, que l’hydrogène, élément le plus léger, ne contenait qu’une seule de ces particules éjectables du noyau. Or, il avait en tête, le terme “protyle” utilisé par Prout à propos de l’hydrogène. Il proposa ainsi de baptiser cette particule élémentaire présente dans tous les noyaux du nom de “prouton” ou “proton”. Ce mot dérivait du singulier neutre du mot grec πρῶτον signifiant “premier”. Le nom “proton” fut par la suite choisi et adopté par la communauté scientifique dès 1920.
Le neutron
La même année, Ernest Rutherford conçoit aussi l’existence d’une particule sans charge électrique. Cette dernière permettrait de rendre compte, par sa présence, de l’existence de plusieurs isotopes pour un même nombre de protons. Rutherford voulait rester fidèle à son modèle planétaire, pourtant complètement faux. Il imagine donc que le neutron était formé d’un électron gravitant autour du proton. Selon ce modèle, l’isotope 14N serait composé de 14 protons et 7 électrons, expliquant son numéro atomique Z = 14 – 7 = 7 et sa masse atomique A = 14. Mais, la physique quantique naissante doucha bien vite son enthousiasme. Car, elle démontra qu’une particule aussi légère que l’électron ne pouvait rester dans une région aussi petite que celle du noyau.
En 1931, les physiciens allemands Walther Bothe et Herbert Becker s’amusaient avec des particules alpha très énergétiques. Comme celles émises par le polonium. Ils constatèrent alors qu’elles étaient capables de produire une radiation extrêmement pénétrante. Il suffisait pour cela de les envoyer sur des éléments légers comme le béryllium, le bore ou le lithium. On pensa tout d’abord à des rayons gamma. Mais, on trouva très vite que ces rayons étaient bien plus pénétrants que tous les rayons gamma connus à l’époque. En 1932, le physicien anglais James Chadwick, démontra alors de manière irréfutable qu’il s’agissait en fait d’un faisceau de particules ayant une masse très proche de celle du proton. Mais, ne possédant aucune charge électrique qu’il baptisa “neutrons”.
Les atomes
Pour résumer, un atome est, pour ce qui concerne la chimie et la biologie, un assemblage de protons, de neutrons et d’électrons. Les protons et les neutrons se trouvent confinés à l’intérieur du noyau atomique. La taille de ce noyau est de l’ordre de 10 fm. Le nombre de protons Z définit la nature chimique de l’atome. Le nombre de masse A est lui égal à la somme du nombre de protons et de neutrons. Il permet de distinguer les différents isotopes d’un même élément chimique.
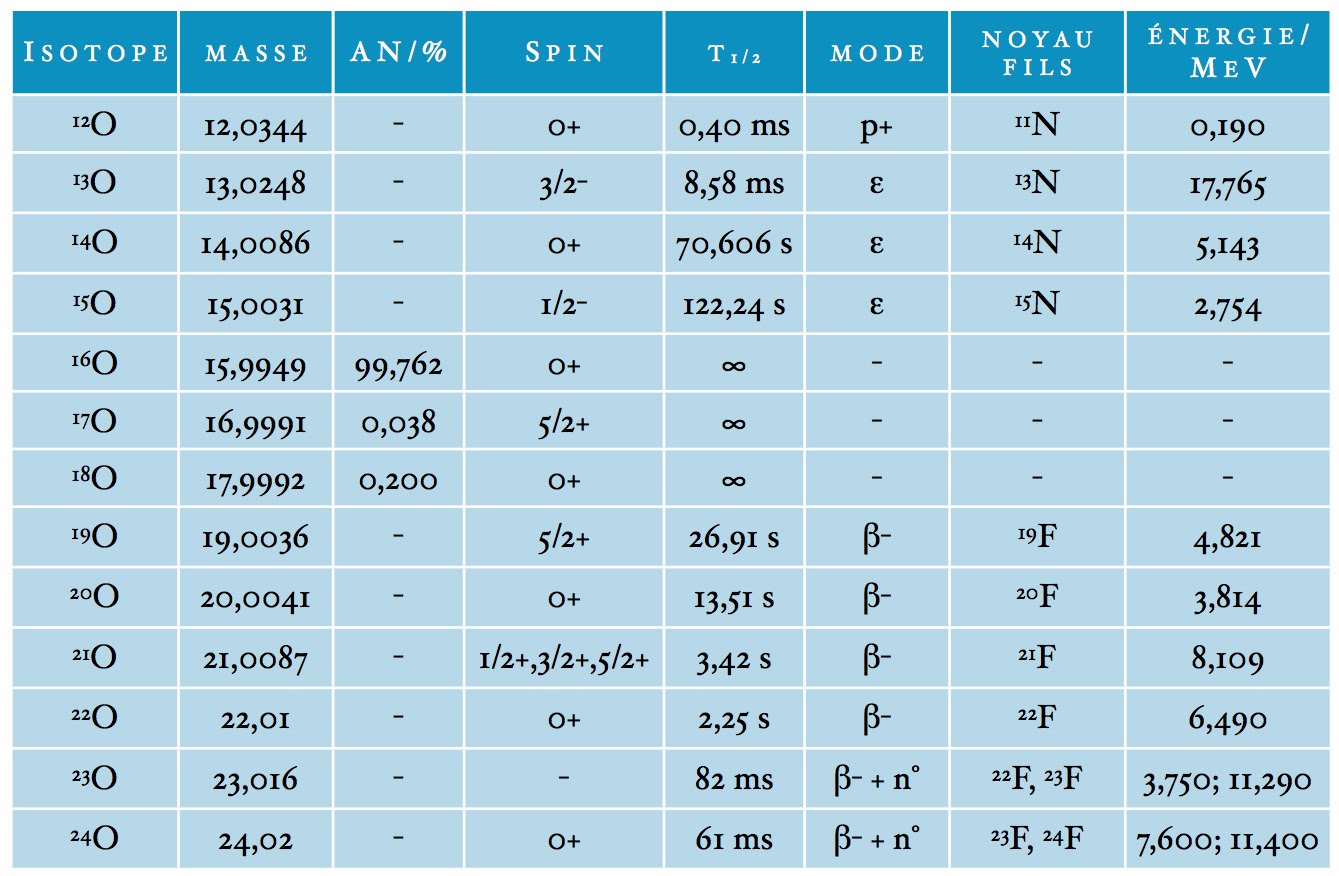
Enfin s’il y a Z protons dans le noyau, il y a forcément Z électrons dans l’atome. Mais, ces électrons sont très éloignés en moyenne du noyau. Ils se localisent dans des couches ayant une taille de l’ordre de 0,1 nm ou 100 pm. Considérons à titre d’exemple, la table des isotopes naturels et artificiels de l’oxygène. Ici, l’acronyme “AN” désigne l’abondance naturelle relative lorsque l’isotope est stable.
Temps de demi-vie
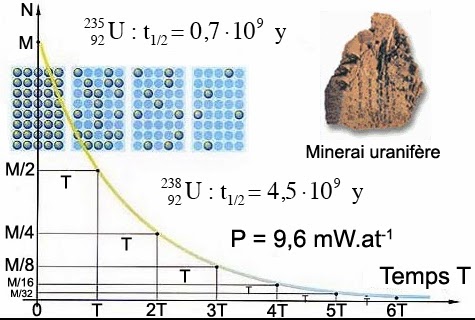
Le spin de l’isotope est une propriété quantique lui permettant d’être actif en résonance magnétique nucléaire (RMN). Le temps de demi-vie T1/2, ou période radioactive, est le temps qu’il faut attendre pour voir décroître de moitié un nombre donné d’atomes radioactifs. Ce terme fut forgé en 1907 par Ernest Rutherford et caractérise le mode de décroissance exponentiel des substances radioactives. Ainsi, soit n .le nombres de périodes écoulées. Alors le pourcentage d’atomes restants sera de 100/(2n). C’est-à-dire 50% au bout d’une période, 25% au bout de 2 périodes, 12,5% au bout de 3 périodes et ainsi de suite.
Les modes de désintégration permettent de “transmuter” les éléments entre eux en faisant varier soir le numéro atomique Z, soit le poids atomique A. Ainsi, le mode p+ correspond à l’émission d’un proton, soit : (A, Z) → (A-1, Z-1), ε à la capture d’un électron : (A, Z) → (A, Z-1), β- à l’émission d’un électron : (A, Z) → (A, Z+1) et n0 à l’émission d’un neutron : (A, Z) → (A-1,Z). Cette table montre que l’oxygène de numéro atomique Z = 8 possède 13 isotopes ayant un nombre de neutrons N = A – Z. On remarquera qu’il n’y a que trois isotopes naturels stables présentant une durée de vie T1/2 infinie.
On constate également que l’isotope de masse 16 présentant le même nombre de protons et de neutrons écrase en abondance naturelle les deux autres de masse 17 et 18. Cela ne veut pas dire que ces deux derniers isotopes soient dénués d’intérêt puisque le premier 17O est le seul isotope stable de l’oxygène à avoir un spin nucléaire différent de zéro. L’autre isotope 18O joue quant à lui un rôle primordial en climatologie puisque grâce à lui on peut définir un thermomètre isotopique permettant de connaître la température moyenne de la planète terre au cours des siècles et des millénaires passés.


Leave a Reply