Énergie interne U et enthalpie H
Le premier principe de la thermodynamique peut s’écrire sous deux formes entièrement équivalentes. Si l’on travaille à chaleur Q et volume constant V, on a :
dU = dQ – P·dV
Par contre, si l’on travaille ou à chaleur et pression constante, on aura plutôt :
dH = dQ + V·dP
Ces deux fonctions d’états U (énergie interne) et H (enthalpie) sont reliées l’une à l’autre par une transformation de Legendre H = U + p·V. En fait, ces expressions ne sont valables en toute rigueur que pour les matières gazeuses. Car, dans un tel état les énergies potentielles sont négligeables devant l’énergie cinétique de mouvement. Dans le cas des solides, l’énergie interne U peut s’exprimer au moyen d’une certain nombre de paires de variables conjuguées selon :
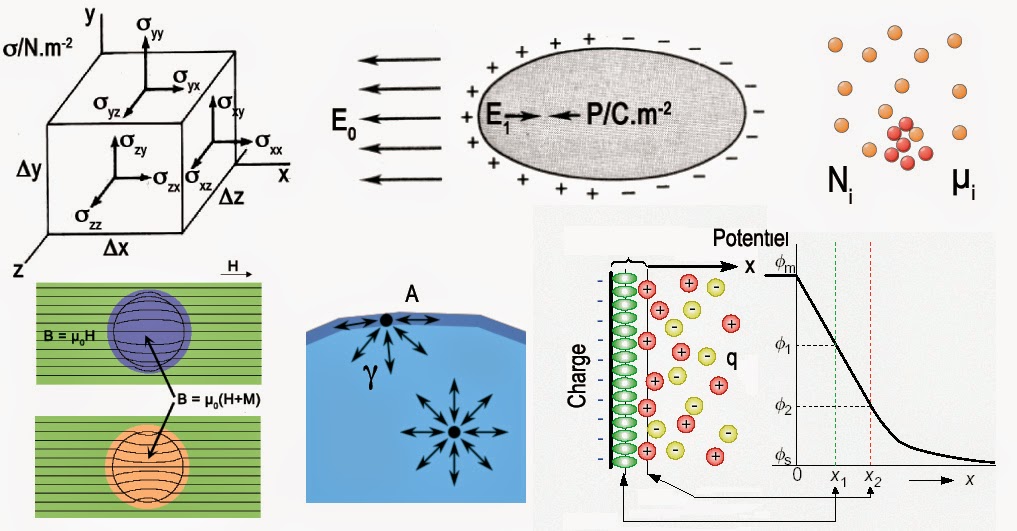
dU = dQ + \sum\limits_{i = 1}^3 {\sum\limits_{j = 1}^3 {{\sigma _{ij}}d(V{\eta _{ij}})} } - \sum\limits_{i = 1}^3 {{E_i}d(V{P_i})} - \sum\limits_{i = 1}^3 {{B_i}d(V{M_i})} + \sum\limits_{i = 1}^n {{\mu _i}d{N_i}} + \phi dq + \gamma dAÉnergies potentielles
Cette expression s’applique à tout solide. Elle prend en compte, toutes les formes d’énergie potentielles. Ainsi, le premier terme fait intervenir le tenseur de déformation en volume V·ηij qui s’exprime en unité m3. Sa variable conjuguée est le tenseur de contraintes σij qui s’exprime en N·m-2. Le second terme traduit la polarisation électrique de la matière sous l’effet d’un champ électrique Ei dont l’unité est le V·m-1. Sa variable conjuguée est le moment dipolaire volumique V·Pi qui s’exprime en C·m. Il y a aussi la magnétisation sous en la présence d’une densité de flux magnétique Bi mesurée en teslas (T). La variable conjuguée est dans ce cas, le moment magnétique en volume V·Mi qui s’exprime en A·m2.
Le terme suivant prend compte toute transformation chimique. On y retrouve la variable conjuguée du potentiel chimique µi qui s’exprime en J·mol-1 ) qui est le nombre de moles Ni. Les termes suivants s’appliquent à la surface du solide et non à son volume. Il y a donc la variable conjuguée du potentiel électrique φ(V) qui est la charge électrique interfaciale q(C). Enfin si A est l’aire du système, sa variable conjuguée est l’énergie interfaciale γ qui s’exprime en J·m-2. Pour un système en rotation, il faudrait encore rajouter un terme ω·dL. Ici, ω est la vitesse angulaire de rotation en rad·s-1 et L le moment cinétique qui s’exprime en J.s·rad-1). De plus, comme on l’a déjà dit on pourrait ajouter un terme m·g·h pour tenir compte de l’altitude h du solide
Un cas très particulier
Soit un corps pur (µ1 = 0), d’extension infinie (γ = 0, φ = 0) et placé au ras du sol (h = 0). Supposons aussi qu’il soit immobile (ω = 0) et éloigné de tout champ électrique Ei = (0,0,0) ou magnétique Bi = (0,0,0). S’il est de surcroît liquide ou gazeux (σij = -P·δij et dV = V(dη11 + dη22 + dη33), on retrouve alors l’expression la plus simple du premier principe :
dU = dQ – P·dV
Ceci illustre bien tout ce que recouvre le terme d’énergie interne. On comprend aussi très bien la portée très générale des raisonnements thermodynamiques. Car, ces derniers transcendent toutes les disciplines scientifiques : mécanique, électromagnétisme, chimie, biologie, etc.


Leave a Reply