La situation au XIXᵉ siècle
La théorie atomique de la matière trouve son origine dans la Grèce antique. Vers la fin du dix-neuvième siècle, elle arrive enfin à s’imposer comme la seule alternative possible à la formalisation de la chimie. Suite à l’établissement d’une classification périodique des éléments, le chimiste et mathématicien russe Dmitri Mendeleev est devenu une autorité reconnue. Ce tableau périodique des éléments a permis de sortir définitivement la chimie moderne de son cocon hermétique et alchimique.
La chimie triomphe sur tous les tableaux. On remplace les anciens pigments de couleurs hors de prix par des molécules colorantes synthétiques bon marché. Les premiers médicaments et les premiers vaccins voient le jour. La métallurgie bat son plein pour fabriquer des machines à vapeur. On assiste à la découverte des premiers polymères. On voit apparaître les premiers engrais chimiques qui révolutionnent déjà les pratiques agricoles. Chaque jour qui passe amène aussi de nouveaux catalyseurs, etc.
Le nombre d’Avogadro
La pression qu’exerce la théorie atomique de la matière sur la vie de tous les jours est immense. Afin de convaincre les derniers récalcitrants, français pour la plupart, un physicien français, Jean Perrin, va mesurer le nombre d’Avogadro au moyen de 13 techniques différentes. L’idée est de convaincre ces derniers dinosaures d’embrasser la cause atomique et de renoncer à leurs équivalents inutiles et non pertinents.
Une boule d’électricité
C’est dans ce contexte que les physiciens vont bien sûr s’intéresser à l’atome. Ils découvrent alors qu’il s’agit en fait d’une petite boule d’électricité présentant des charges positives et négatives en nombre égal. Toutefois, ces charges étaient réparties de manière très inégale dans l’espace.
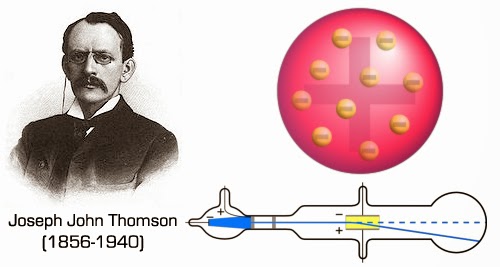
Jusqu’en 1897, les scientifiques pensaient que les atomes étaient indivisibles et constituaient donc les particules ultimes de matière. En 1897, le physicien anglais Joseph John Thomson montra que les rayons cathodiques émis par les tubes de Crookes, subissaient une déviation en traversant un atome. Cela signifiait que les atomes contenaient donc des corpuscules de charge négative 1800 fois plus légers que l’atome d’hydrogène.
L’atome vu comme un plum pudding
Or, des travaux antérieurs du physicien irlandais George Johnstone Stoney (1826-1911) avaient désigné, dès 1874, par le terme électron l’atome d’électricité. On identifia ainsi les corpuscules de Thomson aux électrons responsables des phénomènes électriques. Thomson pensait que ces corpuscules étaient émis par les atomes de gaz résiduels restant dans le tube. Il en conclut que les atomes étaient divisibles. Afin d’expliquer la neutralité électrique de l’atome, il proposa que les électrons évoluaient dans une mer uniforme de charges positives.
Le modèle dit du « plum pudding » venait de naître. Un fait maintenant oublié sur ce modèle est qu’il s’agissait, contrairement à ce que son nom suggère, d’un modèle dynamique, et non statique. Les électrons étaient libres de tourner dans un gel ou nuage de substance positive. Lorsqu’un électron se déplaçait loin du centre du nuage de matière positive, il était «rattrapé» par une force d »attraction positive. Car sinon, en accord avec le théorème de Gauss de l’électrostatique, il y aurait alors plus de matériau de charge opposé dans son orbite.
Une crucis experimentum
Vers 1909 le physicien néozélandais Ernest Rutherford recruta deux ingénieurs Hans Geiger et Ernest Mardsen. Ils imaginèrent une expérience cruciale qui révéla que le modèle du plum pudding était problématique. L’expérience consistait à envoyer des faisceaux de particules alpha sur des feuilles métalliques d’aluminium, de fer, de plomb ou d’or. Geiger et Mardsen réalisèrent ces expériences sous vide dans une obscurité parfaite. Rutherford se chargea de l’interprétation des résultats.
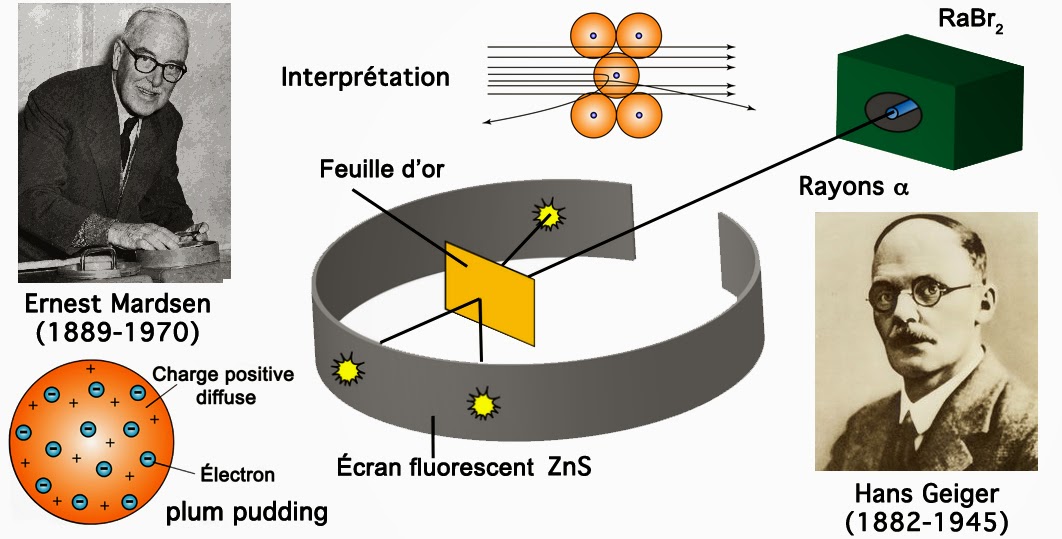
On plaça dans une boîte du dibromure de radium disponible grâce aux travaux de Marie Curie. Ceci permettait de produire un faisceau de particules α chargés positivement. On s’arrangea pour que ce faisceau traverse une fine feuille d’or d’une épaisseur de quelques microns. Derrière cette feuille d’or, se trouvait un écran enrichi en sulfure de zinc ZnS. Ceci afin de visualiser, par un scintillement lumineux, le point d’impact des particules α avec l’écran.
Vide atomique
Plusieurs minutes après la disposition du matériel, différents points lumineux apparaissaient sur l’écran. On constata alors avec stupeur qu’une majorité de particules α traversaient la feuille d’or, comme si cette dernière n’existait pas. Seule une fraction infime de ces particules, de l’ordre de 0,01 %, subissaient une déviation à grands angles. Comme le soulignait Rutherford lui-même: « C’est un peu comme si vous tiriez un obus de 50 mm sur une feuille de papier et que cette dernière vous le renvoie à la figure au lieu de se laisser traverser… »
De cette expérience cruciale, Rutherford déduisit que la matière possédait une structure hautement lacunaire étant constituée essentiellement de vide. C’était la seule explication permettant de comprendre que la plupart des particules ignoraient la présence de la feuille d’or. Il déduisit aussi qu’il existait aussi des îlots de charge positive qui repoussaient les particules α. L’ordre de grandeur de ces îlots est infiniment petit par rapport à la dimension de l’atome lui-même.
Le modèle de Rutherford
Pour analyser les résultats, Rutherford supposa que, lors d’une collision, l’énergie cinétique se transformait en énergie électrostatique. Il fut ainsi capable d’estimer l’ordre de grandeur de la taille d’un noyau d’atome d’or. Car on connaissait la masse (m = 6,7⨯10-27 kg, la charge (q1 = 2⨯1,6⨯10-19 C) et la vitesse (v = 2⨯107 m·s-1) des particules α. De même, on connaissait la charge électrique totale d’un noyau d’or (q2 = 79⨯1,6⨯10-19 C). Rutherford obtint ainsi une taille extraordinairement petite de 10 millionième de milliardième de mètre (10-14 m).
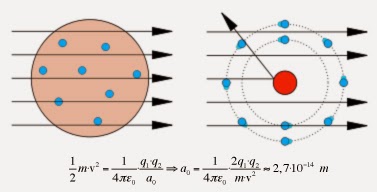
Sachant que l’atome neutre est 10 000 fois plus grand (10-10 m), cela signifiait qu’en volume, l’atome contenait 99,9999999999% de vide… Suite à cette expérience, Rutherford proposa dès 1911 un modèle planétaire de l’atome. Les électrons, portant les charges négatives, se comportaient comme des satellites orbitant autour d’un noyau positif très petit.
La grande crise de la physique
Hélas, à peine né, le modèle planétaire de l’atome fut condamné à mort sans appel par les lois de la physique classique. En effet, selon les équations de Maxwell, toute charge électrique subissant une accélération a rayonne de l’énergie E avec un taux proportionnel au carré du produit de la charge par l’accélération. Ceci est une loi incontournable de la physique responsable de toutes les émissions télé ou radio caractérisant notre époque. On ne peut tout simplement pas remettre cela en question.
Or, comme on le sait bien, toute masse m qui est obligée de tourner sur un cercle de rayon R avec une vitesse v subit une accélération radiale et centripète. Par conséquent, si comme le prétend Rutherford, les électrons gravitent autour du noyau comme les planètes gravitent autour d’une étoile, l’atome doit rayonner son énergie mécanique de manière continue sous la forme d’ondes électromagnétiques.
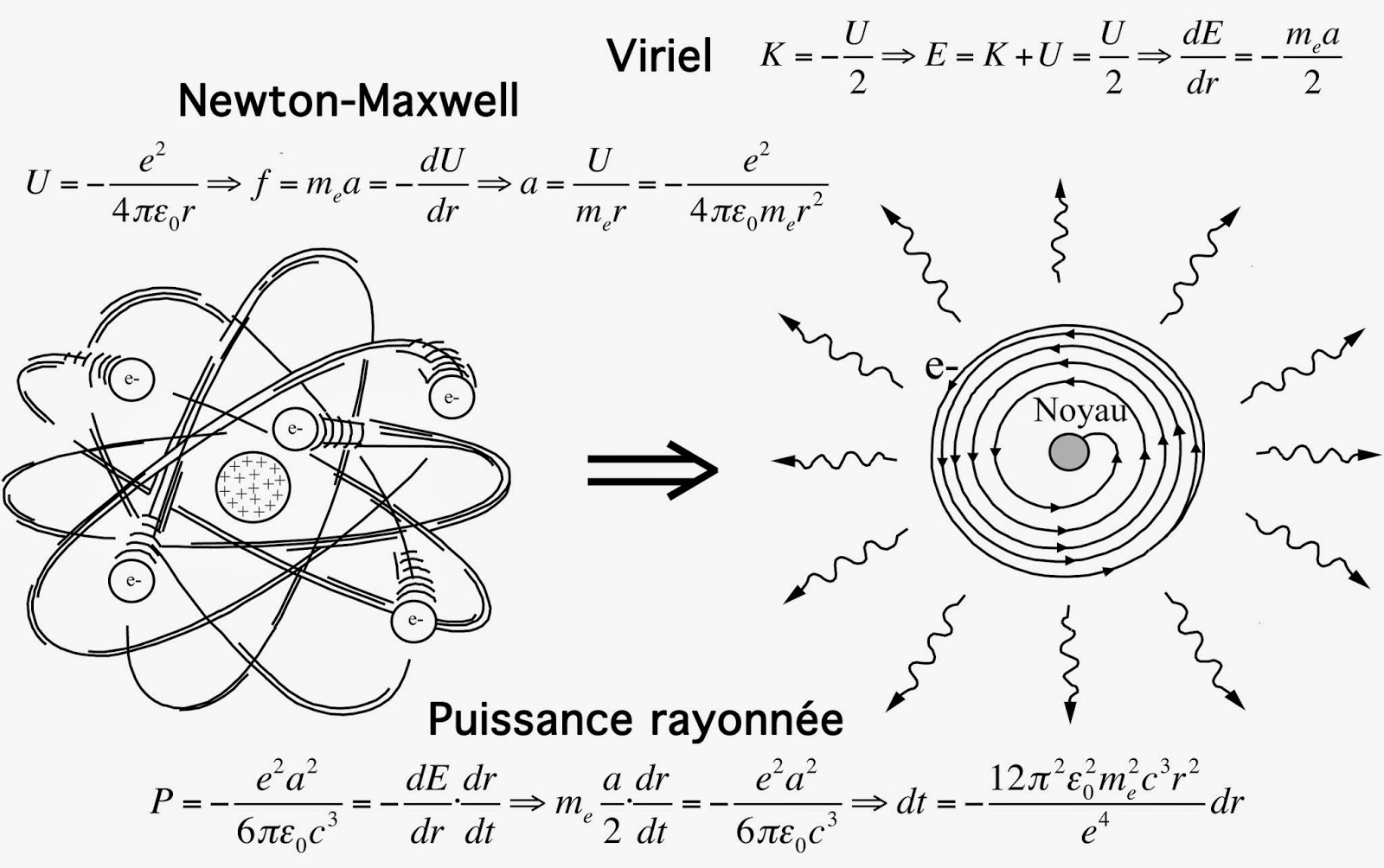
Implosion de l’atome
La figure ci-dessus montre comment évaluer la durée de vie approximative d’un atome selon la physique classique. Il suffit pour cela d’identifier le produit de la masse par l’accélération centripète maintenant l’électron sur orbite à la force de Coulomb. Ceci fournit la valeur de l’accélération a. Ensuite il faut appliquer le théorème du viriel pour obtenir une expression de l’énergie en fonction du rayon de l’orbite r. Puis, on égalise le produit du taux de variation dans le temps de ce rayon par le taux de variation de l’énergie à la puissance électromagnétique rayonnée P.
Tous calculs faits, on trouve que la taille R de l’atome décroît au cours du temps avec une durée de vie T proportionnelle au cube de la taille de départ: T(sec) = 3,15·1020xR(m)3. Partant d’une taille R voisine de 1 Å = 10-10 m, valeur déduite de la théorie cinétique des gaz, la durée de vie d’un tel édifice sera de donc l’ordre de 315 millième de milliardième de secondes (315 ps). Un peu bref pour une chose censée être éternellement stable.
Une énigme apparemment insoluble
En effet, d’un côté toute la chimie clamait haut et fort que toute matière était faite d’un assemblage d’atomes indéfiniment stables. On savait ainsi qu’un atome avait une taille voisine de 10-10 m. D’un autre côté la physique démontrait piteusement que ces mêmes atomes avaient une durée de vie ridiculement faible. Ainsi, au lieu d’un monde fait d’atomes, on devait avoir un monde rempli de rayonnements venant de toutes les directions.
On ne pouvait évidemment pas continuer comme cela et une révision sérieuse des lois de la physique s’imposait. Toutefois, comment faire pour provoquer une révolution sans toucher aux avantages acquis ? Telle était l’épineuse question de ce début de vingtième siècle. C’est pour cette raison très précise, que l’on développa une théorie révolutionnaire : la physique quantique.



Leave a Reply